题目内容
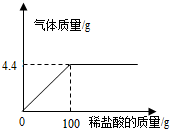 化学探究小组为测定石灰石样品中碳酸钙的质量分数,取15g样品放入烧杯,然后逐滴加入一定质量分数的盐酸反应(杂质不溶于水也不参与反应),加入的酸与生成气体的关系如下.请完成:
化学探究小组为测定石灰石样品中碳酸钙的质量分数,取15g样品放入烧杯,然后逐滴加入一定质量分数的盐酸反应(杂质不溶于水也不参与反应),加入的酸与生成气体的关系如下.请完成:(1)样品中碳酸钙的质量分数;
(2)恰好完全反应时所得溶液中溶质的质量分数.(结果均精确到0.1%)
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)根据二氧化碳的质量可求出碳酸钙的质量,最后根据质量分数计算公式可求出石灰石样品中碳酸钙的质量分数;
(2)根据二氧化碳的质量可求出生成的氯化钙的质量,所得溶液的质量=反应前各组份的质量之和-气体的质量-杂质的质量,并据溶质的质量分数解答.
(2)根据二氧化碳的质量可求出生成的氯化钙的质量,所得溶液的质量=反应前各组份的质量之和-气体的质量-杂质的质量,并据溶质的质量分数解答.
解答:解:该样品与盐酸反应反应生成二氧化碳为4.4g;
设碳酸钙的质量为x,生成的氯化钙质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
=
=
解得:x=10g,y=11.1g
(1)样品中碳酸钙的质量分数为:
×100%=66.7%;
(2)恰好完全反应时所得溶液中溶质的质量分数:
×100%=10.5%
答:样品中碳酸钙的质量分数为66.7%;所得溶液中溶质的质量分数为10.5%.
设碳酸钙的质量为x,生成的氯化钙质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
| 100 |
| x |
| 111 |
| y |
| 44 |
| 4.4g |
解得:x=10g,y=11.1g
(1)样品中碳酸钙的质量分数为:
| 10g |
| 15g |
(2)恰好完全反应时所得溶液中溶质的质量分数:
| 11.1g |
| 10g+100g-4.4g |
答:样品中碳酸钙的质量分数为66.7%;所得溶液中溶质的质量分数为10.5%.
点评:求反应后所得溶液的质量的质量分数是初中化学计算的一个重点和难点,计算反应后溶液的质量的方法一般是:反应后溶液的质量=反应前各组份的质量之和-气体的质量-沉淀(或杂质)的质量.

练习册系列答案
相关题目
该化学反应3NaHCO3+C6H8O7═C6H5O7Na3+3H2O+3( )↑ 括号里物质的化学式.
| A、CO |
| B、CO2 |
| C、CH4 |
| D、C6H8O7 |
 (1)小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定.他们从瓶中取出该溶液共51g,加入适量二氧化锰,生成氧气的质量与反应时间的关系如图所示:则该溶液中所含双氧水的实际质量是多少克?
(1)小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定.他们从瓶中取出该溶液共51g,加入适量二氧化锰,生成氧气的质量与反应时间的关系如图所示:则该溶液中所含双氧水的实际质量是多少克?
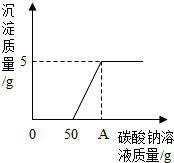 实验室制取二氧化碳后,将废液过滤,得到含有氯化钙和稀盐酸的混合液,20℃时,取混合液141.2g于烧杯中,向其中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,所产生的沉淀与所滴入碳酸钠溶液的质量关系如图所示.当滴入碳酸钠溶液至图中A点时,通过计算确定所得溶液是否为饱和溶液.(提示:20℃时,氯化钠溶解度为36克.)
实验室制取二氧化碳后,将废液过滤,得到含有氯化钙和稀盐酸的混合液,20℃时,取混合液141.2g于烧杯中,向其中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,所产生的沉淀与所滴入碳酸钠溶液的质量关系如图所示.当滴入碳酸钠溶液至图中A点时,通过计算确定所得溶液是否为饱和溶液.(提示:20℃时,氯化钠溶解度为36克.)