题目内容
在实验室里用足量的氢气还原8.0克氧化铜,可以得到多少克铜?
设可以得到铜的质量为x.
H2+CuO
Cu+H2O
80 64
8.0g x
=
x=6.4g
答:在加热条件下,用足量的氢气还原8.0克氧化铜,充分反应后生成6.4g铜.
H2+CuO
| ||
80 64
8.0g x
| 80 |
| 64 |
| 8.0g |
| x |
x=6.4g
答:在加热条件下,用足量的氢气还原8.0克氧化铜,充分反应后生成6.4g铜.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
兴化地处里下河地区,河港纵横,水系发达.但河水中含有较多的碳酸氢钙[Ca(HCO3)2],水的硬度较大.(查阅资料:碳酸氢钙易溶于水.当溶有碳酸氢钙的水遇热时,溶解在水里的碳酸氢钙就会发生分解,生成碳酸钙沉积下来,这就形成了水垢Ca(HCO3)2△CaCO3↓+H2O+CO2↑).已知碳酸氢钠、碳酸氢钾、碳酸氢镁等物质均能在加热条件下发生类似的反应.而碳酸钠、碳酸钾则在通常情况下比较稳定,加热不分解.
请你根据上述信息完成下列各题:
(1)根据上述信息可知,水垢的主要成分是 .你能用什么方法来除去水垢?(用化学方程式表示) .
(2)若碳酸镁粉末中混有少量的碳酸氢镁,请写出除去杂质碳酸氢镁的方法(用化学方程式表示) .
(3)实验室有两包质量均为10.6g的固体,分别是碳酸钠和碳酸氢钠.现分别经如下处理:①充分加热 ②滴加足量的稀盐酸 ③将两步反应生成的气体全部收集后通入足量的澄清石灰水.则生成沉淀的质量 (填“相等”、“不相等”或“无法判断”).
(4)在加热条件下密闭容器内发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质进行测定,测得数据如下:
请回答下列问题:
①上表中的”待测数据”的数值是 .
②此密闭容器内反应类型属于 (填基本反应类型).
③若X是水,Q是能使澄清石灰水变浑浊的气体,且X、Y、Z、Q四种物质的化学计量数之比为1:1:2:1,则物质Y的相对分子质量为 .
(5)实验室制取二氧化碳时若不慎使用了浓盐酸,生成的气体中除混有水蒸气外还可能混有 气体,这是因为浓盐酸具有 性.
现要除去杂质气体,可采用如图所示的装置把不纯的气体进行洗气.
①不纯气体应从 (填“a”或“b”)端通入.
②若只需要把生成的气体干燥,可在瓶中盛放 .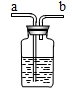
③可在瓶中盛放饱和的碳酸氢钠溶液除去另一种杂质气体.写出有关反应的化学方程式 .
请你根据上述信息完成下列各题:
(1)根据上述信息可知,水垢的主要成分是
(2)若碳酸镁粉末中混有少量的碳酸氢镁,请写出除去杂质碳酸氢镁的方法(用化学方程式表示)
(3)实验室有两包质量均为10.6g的固体,分别是碳酸钠和碳酸氢钠.现分别经如下处理:①充分加热 ②滴加足量的稀盐酸 ③将两步反应生成的气体全部收集后通入足量的澄清石灰水.则生成沉淀的质量
(4)在加热条件下密闭容器内发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质进行测定,测得数据如下:
| 物质 | X | Y | Z | Q |
| 反应前质量(g) | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量(g) | 43.6 | 待测数据 | 4.2 | 8.8 |
①上表中的”待测数据”的数值是
②此密闭容器内反应类型属于
③若X是水,Q是能使澄清石灰水变浑浊的气体,且X、Y、Z、Q四种物质的化学计量数之比为1:1:2:1,则物质Y的相对分子质量为
(5)实验室制取二氧化碳时若不慎使用了浓盐酸,生成的气体中除混有水蒸气外还可能混有
现要除去杂质气体,可采用如图所示的装置把不纯的气体进行洗气.
①不纯气体应从
②若只需要把生成的气体干燥,可在瓶中盛放

③可在瓶中盛放饱和的碳酸氢钠溶液除去另一种杂质气体.写出有关反应的化学方程式
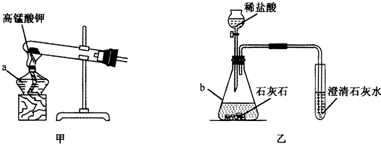
请你结合下列装置图回答问题:

(1)写出有标号仪器的名称:a ,b .
(2)实验室用甲装置制氧气的化学方程式是 ,用 法收集氧气.反应结束后冷却,往试管中加入足量的水,搅拌、过滤,得到黑色粉末.该黑色粉末与过氧化氢接触有大量气泡产生,反应的化学方程式是 ,黑色粉末在反应中的作用是 .
(3)某化学兴趣小组用乙装置制取并检验二氧化碳.实验过程中,可观察到试管里产生 色沉淀,反应的化学方程式是 .产生沉淀后继续通入二氧化碳,过一段时间后,发现沉淀溶解变成澄清溶液.为了确定沉淀溶解成澄清溶液的原因,小组的同学进行了相关探究.
提出问题:沉淀为什么能溶解变成澄清溶液?
查阅资料:碳酸盐溶于酸,碳酸氢钙[Ca(HCO3)2]溶于水.
猜想与假设:①溶液呈酸性;②反应生成了碳酸氢钙.
实验与结论:
通过实验探究得知,生成的沉淀会与二氧化碳、水反应生成可溶于水的碳酸氢钙.
交流与反思 从探究中你得到的启示或感受是 .

(1)写出有标号仪器的名称:a
(2)实验室用甲装置制氧气的化学方程式是
(3)某化学兴趣小组用乙装置制取并检验二氧化碳.实验过程中,可观察到试管里产生
提出问题:沉淀为什么能溶解变成澄清溶液?
查阅资料:碳酸盐溶于酸,碳酸氢钙[Ca(HCO3)2]溶于水.
猜想与假设:①溶液呈酸性;②反应生成了碳酸氢钙.
实验与结论:
| 实验操作 | 实验现象 | 实验结论 |
| 实验Ⅰ:把一小片pH试纸放在一块干净的玻璃片上,用 |
测得被测液的pH=8 | 猜想① (填“成立”或“不成立”) |
| 实验Ⅱ:取沉淀溶解成澄清的溶液于另一支试管中,加入 |
有气体产生 | 反应的化学方程式为: 猜想②成立. |
交流与反思 从探究中你得到的启示或感受是
 铜及其化合物是工业生产和日常生活中常用的物质,下面是对铜及其化合物的探究.
铜及其化合物是工业生产和日常生活中常用的物质,下面是对铜及其化合物的探究.问题一:硫酸铜溶液的配制
小明同学在实验室配制硫酸铜溶液时意外地发现有时会出现少量白色浑浊,对此,他和化学兴趣小组同学作出如下探究.
| 配置用水 | 有浑浊 | 有浑浊 |
| 自来水 | 无浑浊 | 有浑浊 |
| 市售纯净水 | 无浑浊 | 有浑浊 |
| 医用纯净水 | 无浑浊 | 无浑浊 |
| 试验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 饱和溶液 | 2 | 4 | 6 | 8 | 16 | 32 | 128 |
| 现 象 | 白色浑浊→澄清 | ||||||
(1)形成浑浊条件分析:小明分别作出如图1配制方式,并记录现象如下:
另外,他将配好的饱和且澄清的硫酸铜溶液滴入纯净水中有如上现象,在配制过程中形成白色浑浊的因素可能有
(2)白色浑浊成分分析.
[查阅资料]同学们上网查阅资料获知:此白色沉淀是一种名为碱式硫酸铜的物质,它可溶于酸,其有多种可能的组成,如Cu2(OH)2SO4、Cu3(OH)4SO4或Cu4(OH)6SO4等.为确定此次得到的白色沉淀究竟是哪种组成,小明设计实验如下:
[设计实验]称取5.16g白色沉淀,分成两等份:一份溶于足量的 中,向溶液中滴加足量的氯化钡溶液,过滤、洗涤、干燥,得2.33g白色固体;将另一份固体在空气中充分灼烧得到黑色固体1.60g.
[得出结论]通过计算确定该白色沉淀中Cu2+、OH-、SO42-的质量比为
问题二:氢氧化铜与葡萄糖反应产物的分析
利用新制氢氧化铜可以验证葡萄糖的存在.下面是三个研究性学习小组分别从不同层面对此实验开展的研究性学习活动:
Ⅰ.研究性学习小组甲对教材实验结论葡萄糖与新制氢氧化铜反应生成的红色沉淀是Cu2O,提出质疑,他们认为红色沉淀不一定是氧化亚铜.为了确定红色沉淀的成分,开展了如下研究:
提出猜想:红色沉淀可能是
查阅资料:①氧化亚铜能与酸反应,得到+2价的铜离子和单质铜;②在空气中灼烧氧化亚铜生成氧化铜;③铜能与稀硝酸反应生成硝酸铜、水和一氧化氮.
设计方案:方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化;
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣;
方案3:称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次直到固体恒重,称得质量为b g,比较a、b关系;
你认为合理的方案是
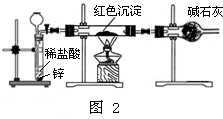
Ⅱ.研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图2所示.
①通入氢气体积 ②反应前,红色沉淀+硬质玻璃管的总质量
③完全反应后,红色固体+硬质玻璃管的总质量 ④实验前,干燥管(含其中固体)质量
⑤硬质玻璃管质量 ⑥锌粒质量 ⑦稀硫酸中含溶质的量 ⑧实验后,干燥管(含其中固体)质量 (已知氢气在加热条件下能与金属氧化物发生置换反应,且假设反应能完全进行)
A.②④⑤⑧B.②③⑤C.①⑥⑦D.①②⑤
你认为需要测定上述
Ⅲ.研究性学习小组丙上网查阅得知,“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”.绿色化学强调对环境友好,实现零排放.“变废为宝”符合绿色化学要求.他们收集上述红色沉淀制备化学试剂--胆矾(CuSO4?5H2O).他们设计了一个简单且符合绿色化学要求的实验方案:将红色固体反复灼烧后,用足量稀硫酸溶解,再将所得溶液蒸发结晶,减压过滤,用少量95%的酒精淋洗晶体,晾干或用滤纸吸干.晶体用酒精淋洗而不用水洗的好处是: