题目内容
7.将二氧化碳气体通入50克氢氧化钠溶液中,完全反应后,溶液的质量变为54.4克,求原氢氧化钠的溶质质量分数.分析 二氧化碳与氢氧化钠溶液反应生成碳酸钠溶液和水,将二氧化碳气体通入50克氢氧化钠溶液中,完全反应后,溶液的质量变为54.4克,溶液增加的质量即为参加反应的二氧化碳的质量,据此结合反应的化学方程式进行分析解答.
解答 解:参加反应的二氧化碳的质量为54.4g-50g=4.4g.
设原氢氧化钠的溶质的质量为x
CO2+2NaOH═Na2CO3+H2O
44 80
4.4g x
$\frac{44}{80}=\frac{4.4g}{x}$ x=8g
原氢氧化钠的溶质质量分数为$\frac{8g}{50g}×$100%=16%.
答:原氢氧化钠的溶质质量分数为16%.
点评 本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
相关题目
17.在化学知识中有许多规律,下列具体物质的性质符合对应规律的是( )
| A. | 某些非金属氧化物能和碱反应生成盐和水;例如:二氧化碳和三氧化硫 | |
| B. | 一般固体物质的溶解度随温度的升高而增大;例如:氢氧化钙和氯化钠 | |
| C. | 常温下金属一般为固态;例如:汞和金 | |
| D. | 置换反应一定有单质和化合物生成;例如:一氧化碳和氧化铁在高温下反应 |
18.西药帕拉米韦(C15H28N4O4)可以治疗H7N9型流感.下列说法,正确的是( )
| A. | 帕拉米韦中含有15个碳原子 | |
| B. | 帕拉米韦中碳元素的质量分数为54.9% | |
| C. | 帕拉米韦的相对分子质量为328g | |
| D. | 帕拉米韦分子中C、H、N、O的元素质量比为15:28:4:4 |
15.某研究性学习小组在课外读物中看到:“通常CO2可做灭火剂,但有些物质(如Na)着火,不能用O2熄火.”他们决定探究CO2与Na反应的产物.

[提出猜想]CO2与Na反应可能产生4种物质:C、CO、Na2CO3和Na2O.
[查阅资料]①Na是非常活泼的金属,常温下能与O2、H2O等物质反应;②NaHCO3饱和溶液不与CO2反应;③Na2O是白色固体;④向银氨溶液[Ag(NH3)2OH]中通入CO产生灰色沉淀.
[实验过程]同学们在老师的指导下设计了如图所示装置(部分夹持仪器已略去).
(1)实验记录
(2)实验反思
①装置B可除去混杂在CO2中的HCl,写出该反应的化学方程式:NaHCO3+HCl=NaCl+CO2↑+H2O;
②若无装置C,对实验有影响的物质是水;
③写出E中出现浑浊所发生反应的化学方程式:Ca(OH)2+CO2═CaCO3↓+H2O;
④[Ag(NH3)2OH]与CO反应,生成灰色沉淀Ag、碳酸铵和氨气,写出该反应的化学方程式:3Ag(NH3)2OH+CO=3Ag+(NH4)2CO3和4NH3↑.

[提出猜想]CO2与Na反应可能产生4种物质:C、CO、Na2CO3和Na2O.
[查阅资料]①Na是非常活泼的金属,常温下能与O2、H2O等物质反应;②NaHCO3饱和溶液不与CO2反应;③Na2O是白色固体;④向银氨溶液[Ag(NH3)2OH]中通入CO产生灰色沉淀.
[实验过程]同学们在老师的指导下设计了如图所示装置(部分夹持仪器已略去).
(1)实验记录
| 序号 | 实验操作 | 主要实验现象 | 实验结论及解释 |
| ① | 打开a,关闭b,由长颈漏斗注入稀盐酸 | I.A中产生大量气泡 II.E中出现浑浊 | E中出现浑浊后,再点燃酒精灯的目的是:排出装置中的空气,防止空气的干扰 |
| ② | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | I.D中Na剧烈燃烧,产生白烟.内壁附着黑色、白色固体 II.G中产生灰色沉淀 | D试管中的反应产物一定有C和CO |
| ③ | 取反应后D中少量白色固体于另一支试管中,加水溶解,再加入CaCl2稀溶液 | 产生白色沉淀 | D试管中的反应产物还有Na2CO3 |
①装置B可除去混杂在CO2中的HCl,写出该反应的化学方程式:NaHCO3+HCl=NaCl+CO2↑+H2O;
②若无装置C,对实验有影响的物质是水;
③写出E中出现浑浊所发生反应的化学方程式:Ca(OH)2+CO2═CaCO3↓+H2O;
④[Ag(NH3)2OH]与CO反应,生成灰色沉淀Ag、碳酸铵和氨气,写出该反应的化学方程式:3Ag(NH3)2OH+CO=3Ag+(NH4)2CO3和4NH3↑.
2.除去下列物质中的杂质,所选试剂或操作方法不正确的一组是( )
| 物质 | 杂质 | 除去杂质的试剂或方法 | |
| A | NaCl | KNO3 | 溶解、降温结晶、过滤、蒸发结晶 |
| B | CaO | CaCO3 | 适量稀盐酸 |
| C | NaCl溶液 | Na2SO4溶液 | 适量Ba(NO3)2溶液 |
| D | Cu | Fe | CuSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
19.下列实验操作中,正确的是( )
| A. |  取用固体药品 | B. |  熄灭酒精灯 | ||
| C. |  稀释浓硫酸 | D. |  检查装置的气密性 |
16.二十一世纪是海洋开发与利用的世纪,海洋化学资源的综合利用将是重点发展领域之一.以下是某研究性学习小组在探究海水综合利用中遇到的问题,请你参与解决并填空:
问题一、海水制镁过程中如何富集氯化镁?
甲、乙、丙三位同学各自提出自己的设想:
甲:直接往海水中加入石灰乳.
乙:高温加热蒸发海水后,加入石灰乳.
丙:向晒盐后的卤水中,加入石灰乳.
通过分析比较,你认为丙的设想最为经济合理(选填“甲”、“乙”或“丙”).
问题二、海水“制碱”的产物成分是什么?
同学们从某企业取回少量碳酸氢钠受热完全分解后的固体样品,为确定其成分,进行了如下探究:
【提出猜想】
甲的猜想:样品中只含有碳酸钠;
乙的猜想:样品中含有碳酸钠和氢氧化钠;
丙的猜想:样品中只含有氢氧化钠.
他们做出上述三种猜想的科学依据是化学反应前后元素的种类不变(元素守恒).
【实验、记录与分析】
问题一、海水制镁过程中如何富集氯化镁?
甲、乙、丙三位同学各自提出自己的设想:
甲:直接往海水中加入石灰乳.
乙:高温加热蒸发海水后,加入石灰乳.
丙:向晒盐后的卤水中,加入石灰乳.
通过分析比较,你认为丙的设想最为经济合理(选填“甲”、“乙”或“丙”).
问题二、海水“制碱”的产物成分是什么?
同学们从某企业取回少量碳酸氢钠受热完全分解后的固体样品,为确定其成分,进行了如下探究:
【提出猜想】
甲的猜想:样品中只含有碳酸钠;
乙的猜想:样品中含有碳酸钠和氢氧化钠;
丙的猜想:样品中只含有氢氧化钠.
他们做出上述三种猜想的科学依据是化学反应前后元素的种类不变(元素守恒).
【实验、记录与分析】
| 步骤 | 实验操作 | 实验现象 | 结论 |
| (1) | 取少量样品于试管中,加水完全 溶解,再加入过量的氯化钙溶液 | 生成白色沉淀 | 丙的猜想 不成立 |
| (2) | 取步骤1反应后的溶液与试管中, 滴加无色酚酞试液 | 无明显现象(不显红色) | 只有甲的 猜想成立 |
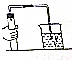 检查装置的气密性(如图),连接好仪器,先将导管的一端浸没在水里,然后双手紧贴容器外壁,若导管口有气泡冒出,移开手,在导管内形成一段水柱,则不漏气.
检查装置的气密性(如图),连接好仪器,先将导管的一端浸没在水里,然后双手紧贴容器外壁,若导管口有气泡冒出,移开手,在导管内形成一段水柱,则不漏气.