题目内容
初三(2)班同学为了探究某氧化钙(CaO)样品中混有碳酸钙(CaCO3)杂质.现取样品6.6g,经高温灼热至碳酸钙完全分解(CaC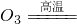 CaO+CO2↑),称得残留固体的质量为6.16g(反应后残留固体在干燥器内冷却至室温后再称量).求:
CaO+CO2↑),称得残留固体的质量为6.16g(反应后残留固体在干燥器内冷却至室温后再称量).求:
(1)样品中碳酸钙的质量;______
(2)样品中氧化钙的质量分数;______
(3)样品中钙元素的质量分数.______.
解:根据质量守恒定律可知,生成的二氧化碳质量是:6.6g-6.16g=0.44g,
设生成0.44克的二氧化碳需要碳酸钙为x,
CaCO3 CaO+CO2↑
CaO+CO2↑
100 44
x 0.44g
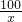 =
=
x=1g,
所以氧化钙为:6.6-1=5.6克,
所以氧化钙质量分数为: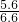 ×100%=84.8%
×100%=84.8%
钙元素的质量:1g× +5.6g×
+5.6g× =4.4g
=4.4g
钙元素的质量分数为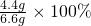 ≈66.7%
≈66.7%
故答案为:(1)1g;
(2)84.8%;
(3)66.7%.
分析:根据反应后固体减少的是二氧化碳,根据质量守恒定律计算出二氧化碳的质量,再根据方程式计算出碳酸钙的质量,计算该与元素的质量根据物质的元素质量分数进行计算.
点评:在解此类题时,首先分析题中的反应原理,然后根据题中的数据进行求解.
设生成0.44克的二氧化碳需要碳酸钙为x,
CaCO3
 CaO+CO2↑
CaO+CO2↑100 44
x 0.44g
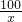 =
=
x=1g,
所以氧化钙为:6.6-1=5.6克,
所以氧化钙质量分数为:
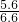 ×100%=84.8%
×100%=84.8%钙元素的质量:1g×
 +5.6g×
+5.6g× =4.4g
=4.4g钙元素的质量分数为
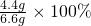 ≈66.7%
≈66.7%故答案为:(1)1g;
(2)84.8%;
(3)66.7%.
分析:根据反应后固体减少的是二氧化碳,根据质量守恒定律计算出二氧化碳的质量,再根据方程式计算出碳酸钙的质量,计算该与元素的质量根据物质的元素质量分数进行计算.
点评:在解此类题时,首先分析题中的反应原理,然后根据题中的数据进行求解.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
我市某校初三(1)班学生去湖光岩春游,带回了几小块石灰石样品.为了检测样品中碳酸钙的含量,甲、乙、丙、丁四位同学用质量分数相同的盐酸与样品充分反应来讲行实验测定,(样品中的杂质不溶于水,且不与盐酸反应),测得数据如下表:
试问答:
(1)10.0g样品与45g盐酸充分反应后,盐酸是否还剩余 (填“是”或“否”),样品中碳酸钙的质量分数是 .
(2)10.0g样品与足量稀盐酸反应后可产生二氧化碳多少克?(写出计算过程,计算结果精确到小数点后两位)
| 甲同学 | 乙同学 | 丙同学 | 丁同学 | |
| 所取石灰石样品质量(g) | 10.0 | 10.0 | 10.0 | 10.0 |
| 加入盐酸的质量(g) | 20.0 | 30.0 | 45.0 | 50.0 |
| 剩余固体的质量(g) | 6.0 | 4.0 | 1.0 | 1.0 |
(1)10.0g样品与45g盐酸充分反应后,盐酸是否还剩余
(2)10.0g样品与足量稀盐酸反应后可产生二氧化碳多少克?(写出计算过程,计算结果精确到小数点后两位)
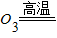 CaO+CO2↑),称得残留固体的质量为6.16g(反应后残留固体在干燥器内冷却至室温后再称量).求:
CaO+CO2↑),称得残留固体的质量为6.16g(反应后残留固体在干燥器内冷却至室温后再称量).求: