题目内容
20.比较水通电分解和过氧化氢分解的反应,下列说法中错误的是( )| A. | 反应条件不同 | B. | 生成物都是单质 | ||
| C. | 都遵循了质量守恒定律 | D. | 两个反应都属于分解反应 |
分析 A、水通电分解和过氧化氢分解的条件,进行分析判断.
B、通电分解生成氢气和氧气,过氧化氢分解生成水和氧气,进行分析判断.
C、根据一切化学反应均遵守质量守恒定律,进行分析判断.
D、分解反应:一种物质反应后生成两种或两种以上的物质,其特点可总结为“一变多”.
解答 解:A、水通电分解和过氧化氢分解的条件分别是通电、常温下就能反应,反应条件不同,故选项说法正确.
B、通电分解生成氢气和氧气,过氧化氢分解生成水和氧气,生成的水是化合物,故选项说法错误.
C、一切化学反应均遵守质量守恒定律,故选项说法正确.
D、两个反应均符合“一变多”的特征,均属于分解反应,故选项说法正确.
故选:B.
点评 本题难度不大,掌握电解水与过氧化氢分解的反应原理、质量守恒定律、分解反应的特征等是正确解答本题的关键.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
15. 如图是某工厂进行电解饱和食盐水生产的原理图,则在电解饱和食盐水时,肯定不能得到的产品是( )
如图是某工厂进行电解饱和食盐水生产的原理图,则在电解饱和食盐水时,肯定不能得到的产品是( )
 如图是某工厂进行电解饱和食盐水生产的原理图,则在电解饱和食盐水时,肯定不能得到的产品是( )
如图是某工厂进行电解饱和食盐水生产的原理图,则在电解饱和食盐水时,肯定不能得到的产品是( )| A. | NaOH | B. | HNO3 | C. | H2 | D. | Cl2 |
11.实验设计是化学实验的重要环节,请根据下列实验要求回答相关问题:
【活动与探究一】用对比实验方法探究二氧化碳的性质.
查阅资料:蓝色石蕊试纸遇酸变红
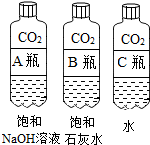
(1)实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O;对比A瓶与C(填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应.
(2)实验二观察到C装置中发生的现象是湿润的蓝色石蕊试纸变红,结论是CO2+H2O═H2CO3(用化学方程式表示).
【活动与探究二】探究燃烧条件:若B处盛放木炭.
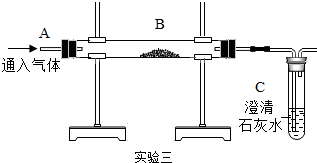
Ⅰ.先在A处通入氮气一段时间后,在B处加热,B、C处没有明显变化;
Ⅱ.待B处冷却至室温,在A处通入氧气一段时间后,B、C处没有明显变化;
Ⅲ.在A处继续通入氧气,然后在B处加热,发现木炭燃烧,C处变浑浊.
(3)Ⅰ与Ⅲ对比,说明燃烧的条件之一是氧气;Ⅱ与Ⅲ对比,说明燃烧的条件之一是温度达到着火点.
【活动与探究三】定量测定空气中氧气的含量.
(4)实验四中,反应的原理为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO(用化学方程式表示);
装置一比装置二更合理,理由是装置一中氧气反应的更充分;
根据如表提供的实验数据,完成如表:
定量实验操作中易产生误差,如果反应前气球中存在气体(其量小于注射器内的空气),而实验后冷却至室温,将气球内的气体全部挤出读数,导致实验测得结果偏小(填“偏小”、“偏大”或“无影响”).
【活动与探究一】用对比实验方法探究二氧化碳的性质.
查阅资料:蓝色石蕊试纸遇酸变红
| 实验一 | 实验二 |
 | 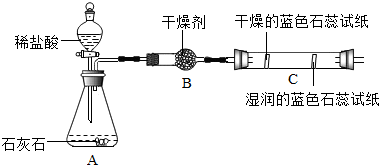 |
(2)实验二观察到C装置中发生的现象是湿润的蓝色石蕊试纸变红,结论是CO2+H2O═H2CO3(用化学方程式表示).
【活动与探究二】探究燃烧条件:若B处盛放木炭.

Ⅰ.先在A处通入氮气一段时间后,在B处加热,B、C处没有明显变化;
Ⅱ.待B处冷却至室温,在A处通入氧气一段时间后,B、C处没有明显变化;
Ⅲ.在A处继续通入氧气,然后在B处加热,发现木炭燃烧,C处变浑浊.
(3)Ⅰ与Ⅲ对比,说明燃烧的条件之一是氧气;Ⅱ与Ⅲ对比,说明燃烧的条件之一是温度达到着火点.
【活动与探究三】定量测定空气中氧气的含量.
| 实验四 | |
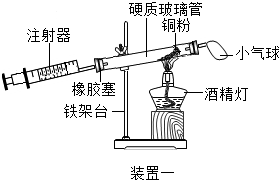 | 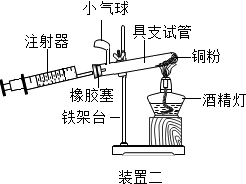 |
装置一比装置二更合理,理由是装置一中氧气反应的更充分;
根据如表提供的实验数据,完成如表:
| 硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
| 30mL | 20mL | 12mL | 16% |
8.下列生产过程中,不发生化学变化的是( )
| A. |  芜湖融汇化工 | B. |  淮南化肥生产 | C. |  宣城宣酒酿造 | D. |  淮北煤炭挖掘 |
10. 目前,科学家提出了一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法正确的是( )
目前,科学家提出了一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法正确的是( )
 目前,科学家提出了一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法正确的是( )
目前,科学家提出了一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法正确的是( )| A. | 燃料电池能够使化学反应产生的能量转化为电能 | |
| B. | 在此循环中发生了反应:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | |
| C. | 该氢能源的循环体系能够实现电能和太阳能的相互转化 | |
| D. | 目前未能使用氢气作为普通燃料的主要原因是氢气易爆炸 |
 如图为甲、乙、丙三种固体物质的溶解度曲线,请据图回答:
如图为甲、乙、丙三种固体物质的溶解度曲线,请据图回答: 实验小组欲利用氢氧化钠溶液与硫酸反应探究中和反应过程中的热量变化.请你参与探究实验.
实验小组欲利用氢氧化钠溶液与硫酸反应探究中和反应过程中的热量变化.请你参与探究实验. 如图为M、N 两种固体饱和溶液溶质的质量分数(C%)随温度(t)变化的曲线.
如图为M、N 两种固体饱和溶液溶质的质量分数(C%)随温度(t)变化的曲线.