题目内容
13.请用化学方程式表示下列反应原理.(1)工业上用碳酸钠溶液和石灰水制取烧碱.
(2)医疗上用含碳酸氢钠的药物治疗胃酸过多症.
(3)工业上用一氧化碳还原氧化铁炼铁.
分析 碳酸钠能和石灰水中的氢氧化钙反应生成白色沉淀碳酸钙和氢氧化钠,烧碱是氢氧化钠的俗称;
碳酸氢钠能和胃酸中的稀盐酸反应生成氯化钠、水和二氧化碳;
高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳.
解答 解:(1)碳酸钠和氢氧化钙反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(2)碳酸氢钠和稀盐酸反应的化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑;
(3)氧化铁和一氧化碳反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;NaHCO3+HCl═NaCl+H2O+CO2↑;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
点评 书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列图象能正确反映对应的实验操作的是( )
| A. |  用一定量的饱和石灰水中加入氧化钙 | |
| B. |  等质量的镁和铝与稀H2SO4反应 | |
| C. |  用一定量的双氧水制氧气 | |
| D. |  向硝酸银溶液中插入铜丝 |
1.已知CaO、CuO、SO2、CO等属于氧化物;NH3、CH4、HF、NaH、KH等属于氢化物.则下列说法中,错误的是( )
| A. | 氢化物可理解为由两种元素组成,其中一种是氢元素的化合物 | |
| B. | 水既属于氧化物又属于氢化物 | |
| C. | 硫酸既属于氧化物又属于氢化物 | |
| D. | 在NaH中,钠元素显+1价 |
8.甲、乙两种物质的溶解度曲线如图所示,下列叙述正确的是( )
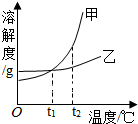

| A. | 将甲的溶液从t2℃降到t1℃,其溶质的质量分数一定减小 | |
| B. | 当温度高于0℃而低于t1℃时,乙的溶解度比甲的溶解度大 | |
| C. | t2℃时,甲、乙的饱和溶液各100g,其溶质的质量一定相等 | |
| D. | t2℃时,蒸发溶剂可使乙的饱和溶液析出晶体后变为不饱和溶液 |
18.乙酰水杨酸(C9H8O4)也叫阿司匹林,是一种历史悠久的解热镇痛药,下列有关乙酰水洗酸这种物质的说法正确的是( )
| A. | 属于氧化物 | |
| B. | 相对分子质量是180 | |
| C. | 碳元素和氧元素的质量比为9:4 | |
| D. | 由9个碳原子、8个氢原子和4个氧原子构成 |
5. 同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶以及氧化铜等.同学们通过如下实验来研究催化剂的某些因素对过氧化氢分解速率的影响.
同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶以及氧化铜等.同学们通过如下实验来研究催化剂的某些因素对过氧化氢分解速率的影响.
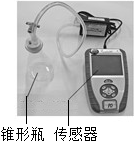
方案Ⅰ:分别取20mL 5%的过氧化氢溶液于3个大小相同的锥形瓶中.向其中两个锥形瓶中分别加入含相同数目金属离子的氯化铁溶液和氯化铜溶液,分别连接传感器测体系压强(如图所示).测定数据如表所示:
(1)加入含相同数目金属离子的氯化铁溶液和氯化铜溶液,该步操作的实验目的是控制金属离子的数目,对比它们对过氧化氢分解速率的影响.
(2)根据上表数据得出的结论是氯化铁溶液催化产生氧气的速率比氯化铜溶液快.
方案Ⅱ:从同一部位取2个质量均为1.7g的正方体土豆块,将其中一块切成若干片,片与片相连不断开,同时分别放入盛30mL 5%过氧化氢溶液的锥形瓶中.均看到有气泡生成,一段时间后,切成片的土豆片表面附着较多的气泡并不断上升.通过实验得出的结论是反应物和催化剂的接触面接越大,反应速率越快.
(3)请写出该反应的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
【实验反思】
(4)通过实验一和实验二说明,测量体系的压强变化也可用于判断过氧化氢的分解速率.除此之外,本实验还可以用其它方法来比较过氧化氢的分解速率,下列做法中不合理的是A(填选项序号).
A.测量完全反应后产生气体的总体积 B.测量产生一定体积气体所需要的时间
C.测量相同时间内生成气体的体积 D.测量相同时间内锥形瓶内物质总质量的变化
(5)小明发现实验过程中锥形瓶外壁发烫,而过氧化氢的分解速率开始时会逐渐增大.查阅资料后得知:过氧化氢分解时放出大量的热,你能不能据此解释其分解速率发生变化的原因?过氧化氢分解时放出热量,温度升高,反应速率加快.
(6)你还能想到对过氧化氢溶液的分解速率产生影响的其他原因吗?请选择一种,设计实验加以验证.过氧化氢溶液的浓度影响分解速率:
实验步骤:室温下,取相同质量的二氧化锰粉末分别加入两支规格相同的试管中,再分别同时加入相同体积、浓度不同的过氧化氢溶液,连接收集装置;
实验现象:浓度大的过氧化氢溶液产生气泡的速率较快,相同时间内浓度大的过氧化氢溶液收集装置中收集的气体体积大;
实验结论:其它条件相同时,过氧化氢溶液的浓度越大,分解速率越快.
 同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶以及氧化铜等.同学们通过如下实验来研究催化剂的某些因素对过氧化氢分解速率的影响.
同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶以及氧化铜等.同学们通过如下实验来研究催化剂的某些因素对过氧化氢分解速率的影响.方案Ⅰ:分别取20mL 5%的过氧化氢溶液于3个大小相同的锥形瓶中.向其中两个锥形瓶中分别加入含相同数目金属离子的氯化铁溶液和氯化铜溶液,分别连接传感器测体系压强(如图所示).测定数据如表所示:
| 时间/s 压强/KPa 试剂 | 0 | 60 | 120 | 180 | 240 | 300 |
| 20mL5%的过氧化氢溶液 | 101.86 | 102.99 | 103.42 | 103.67 | 103.99 | 104.00 |
| 加入氯化铁粉末 | 102.21 | 105.35 | 115.40 | 129.69 | 145.62 | 163.99 |
| 加入氯化铜粉末 | 101.90 | 102.73 | 107.53 | 114.78 | 122.49 | 130.39 |
(2)根据上表数据得出的结论是氯化铁溶液催化产生氧气的速率比氯化铜溶液快.
方案Ⅱ:从同一部位取2个质量均为1.7g的正方体土豆块,将其中一块切成若干片,片与片相连不断开,同时分别放入盛30mL 5%过氧化氢溶液的锥形瓶中.均看到有气泡生成,一段时间后,切成片的土豆片表面附着较多的气泡并不断上升.通过实验得出的结论是反应物和催化剂的接触面接越大,反应速率越快.
(3)请写出该反应的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
【实验反思】
(4)通过实验一和实验二说明,测量体系的压强变化也可用于判断过氧化氢的分解速率.除此之外,本实验还可以用其它方法来比较过氧化氢的分解速率,下列做法中不合理的是A(填选项序号).
A.测量完全反应后产生气体的总体积 B.测量产生一定体积气体所需要的时间
C.测量相同时间内生成气体的体积 D.测量相同时间内锥形瓶内物质总质量的变化
(5)小明发现实验过程中锥形瓶外壁发烫,而过氧化氢的分解速率开始时会逐渐增大.查阅资料后得知:过氧化氢分解时放出大量的热,你能不能据此解释其分解速率发生变化的原因?过氧化氢分解时放出热量,温度升高,反应速率加快.
(6)你还能想到对过氧化氢溶液的分解速率产生影响的其他原因吗?请选择一种,设计实验加以验证.过氧化氢溶液的浓度影响分解速率:
实验步骤:室温下,取相同质量的二氧化锰粉末分别加入两支规格相同的试管中,再分别同时加入相同体积、浓度不同的过氧化氢溶液,连接收集装置;
实验现象:浓度大的过氧化氢溶液产生气泡的速率较快,相同时间内浓度大的过氧化氢溶液收集装置中收集的气体体积大;
实验结论:其它条件相同时,过氧化氢溶液的浓度越大,分解速率越快.
2.逻辑推理是一种重要的化学思维方法,以下推理合理的是( )
| A. | 因为H2O和H2O2的组成元素相同,所以它们的化学性质相同 | |
| B. | 因为燃烧需要同时满足三个条件,所以灭火也要同时控制这三个条件 | |
| C. | 因为蜡烛燃烧生成C02和H2O,所以蜡烛组成里一定含有C和H | |
| D. | 因为碱溶液呈碱性,所以呈碱性的溶液一定都是碱溶液 |
3.关于下列生活经验和化学知识的叙述中,正确的是( )
| A. | 人体不可缺铁,缺铁赶快补铁单质 | |
| B. | 人们为了提高化肥的肥效,把铵态氮肥与草木灰(碱性物质)混合施用 | |
| C. | 淀粉没有甜味,因此不属于糖类 | |
| D. | 喝牛奶、豆浆等富含蛋白质的食物可以缓解重金属盐中毒 |
