题目内容
钠、镁、铝分别与稀盐酸反应,生成等质量氢气时,则参加反应的钠、镁、铝原子个数比为
- A.1:2:3
- B.3:2:1
- C.4:2:1
- D.6:3:2
D
分析:利用一定质量金属完全反应放出氢气质量= ×金属的质量,由生成等质量氢气的条件可计算出三种金属的质量比;再由元素质量比与相对原子量的比,可得到参加反应的钠、镁、铝原子个数比.
×金属的质量,由生成等质量氢气的条件可计算出三种金属的质量比;再由元素质量比与相对原子量的比,可得到参加反应的钠、镁、铝原子个数比.
解答:设生成等质量氢气时,则参加反应的钠、镁、铝三种金属的质量分别为mNa、mMg、mAl,则
 ×mNa=
×mNa= ×mMg=
×mMg=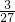 ×mAl,则mNa:mMg:mAl=23:12:9
×mAl,则mNa:mMg:mAl=23:12:9
则参加反应的钠、镁、铝原子个数比= :
: :
: =6:3:2
=6:3:2
故选D.
点评:相对原子质量是原子个数与元素质量之间的桥梁,利用相对原子质量可把原子的个数与元素质量之间建立起联系,即元素质量=相对原子质量×原子个数.
分析:利用一定质量金属完全反应放出氢气质量=
 ×金属的质量,由生成等质量氢气的条件可计算出三种金属的质量比;再由元素质量比与相对原子量的比,可得到参加反应的钠、镁、铝原子个数比.
×金属的质量,由生成等质量氢气的条件可计算出三种金属的质量比;再由元素质量比与相对原子量的比,可得到参加反应的钠、镁、铝原子个数比.解答:设生成等质量氢气时,则参加反应的钠、镁、铝三种金属的质量分别为mNa、mMg、mAl,则
 ×mNa=
×mNa= ×mMg=
×mMg=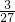 ×mAl,则mNa:mMg:mAl=23:12:9
×mAl,则mNa:mMg:mAl=23:12:9则参加反应的钠、镁、铝原子个数比=
 :
: :
: =6:3:2
=6:3:2故选D.
点评:相对原子质量是原子个数与元素质量之间的桥梁,利用相对原子质量可把原子的个数与元素质量之间建立起联系,即元素质量=相对原子质量×原子个数.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
钠、镁、铝分别与稀盐酸反应,生成等质量氢气时,则参加反应的钠、镁、铝原子个数比为( )
| A、l:2:3 | B、3:2:l | C、4:2:1 | D、6:3:2 |