题目内容
20.宁波有较长的海岸线,每年能生产大量的粗盐.从海水中结晶的食盐一般混有MgCl2、CaCl2、Na2S04等杂质,为了除去上述杂质,生产食用盐设计了如下实验方案:先将固体溶解,然后向溶液中依次加人过量的BaCl2、NaOH、Na2C03溶液,充分反应后过滤,滤液中溶质为NaOH、Na2C03和NaCl.分析 由于加入过量的BaCl2、NaOH、Na2C03溶液,反应后过滤后的溶液中含有过量的碳酸钠和氢氧化钠.
解答 解:由于氯化钡能与硫酸钠反应生成了硫酸钡沉淀,所以,加入BaCl2溶液的目的是为了除去硫酸钠杂质;碳酸钠中的碳酸根离子会与钡离子和钙离子反应生成碳酸钡和碳酸钙沉淀,因此加入Na2CO3溶液的目的是除去溶液中的CaCl2、过量的BaCl2;所以过滤后的溶液中含有过量的碳酸钠和氢氧化钠,
故答案为:NaOH、Na2C03 和NaCl.
点评 本题主要考了在粗盐提纯的试验中对杂质进行转换的探究,除去杂质的同时不能引入新的杂质.以上方案不够完善.应在过滤后增加一个步骤:往滤液中加入适量的稀盐酸除去碳酸钠和氢氧化钠.

练习册系列答案
相关题目
13.下列过程不发生化学变化的是( )
| A. | 碳酸钠晶体在干燥的空气中质量变轻 | |
| B. | 浓盐酸敞口放置质量变轻 | |
| C. | 烧碱溶液试剂瓶口液体蒸发,出现白色固体 | |
| D. | 用生石灰配制石灰水 |
9.下列物质的性质与用途没有直接关系的是( )
| A. | 浓硫酸有吸水性--用作干燥剂 | |
| B. | 稀有气体化学性质稳定--用作保护气 | |
| C. | 氧气密度比空气略大--用于急救病人 | |
| D. | 干冰升华吸热--用于人工降雨 |
10.下列有关实验现象的描述,错误的是( )
| A. | 硫在氧气中燃烧有淡蓝色火焰 | |
| B. | 碳在氧气中燃烧,发出白光 | |
| C. | 细铁丝在氧气中燃烧,火星四射,生成黑色固体 | |
| D. | 二氧化碳通入澄清石灰水中,石灰水变浑浊 |



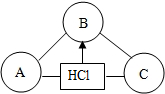 构建知识网络是一种重要的学习方法.右图是关于盐酸化学性质的知识网络,“-”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质.
构建知识网络是一种重要的学习方法.右图是关于盐酸化学性质的知识网络,“-”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质.