题目内容
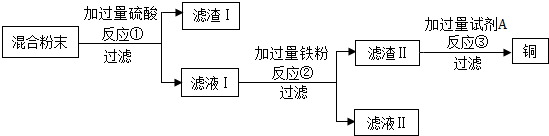
1.氯化钙是重要的化工原料.某工业碳酸钙所含的杂质主要是氧化铁及一些不与酸碱反应的难溶性物质,以这种工业碳酸钙为原料生产氯化钙的主要流程如图所示: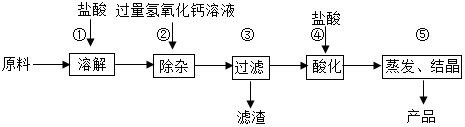
(1)用化学方程式表示由碳酸钙生成氯化钙的反应原理:CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)步骤③得到的滤渣含有氢氧化铁,请写出步骤②发生复分解反应生成氢氧化铁的化学方程式:3Ca(OH)2+2FeCl3═2Fe(OH)3↓+3CaCl2.
(3)步骤④加入盐酸的目的是除去过量的氢氧化钙;步骤⑤利用盐酸的易挥发性质,除去过量的盐酸.
分析 (1)碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,进行分析解答.
(2)步骤②发生复分解反应生成氢氧化铁,即步骤①中氧化铁与稀盐酸反应生成的氯化铁与氢氧化钙反应生成氢氧化铁沉淀和氯化钙,写出反应的化学方程式即可.
(3)经步骤③过滤后得到的滤液中含有过量的氢氧化钙,结合盐酸具有挥发性,进行分析解答.
解答 解:(1)碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)步骤②发生复分解反应生成氢氧化铁,即步骤①中氧化铁与稀盐酸反应生成的氯化铁与氢氧化钙反应生成氢氧化铁沉淀和氯化钙,反应的化学方程式为:3Ca(OH)2+2FeCl3═2Fe(OH)3↓+3CaCl2.
(3)经步骤③过滤后得到的滤液中含有过量的氢氧化钙,步骤④加入盐酸的目的是除去过量的氢氧化钙;盐酸具有挥发性,步骤⑤利用盐酸具有挥发性的性质,蒸发除去过量的盐酸.
故答案为:(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;(2)3Ca(OH)2+2FeCl3═2Fe(OH)3↓+3CaCl2;(3)过量的氢氧化钙;易挥发.
点评 本题难度不大,理解以工业碳酸钙为原料生产氯化钙的主要流程,熟练掌握酸的化学性质、盐的化学性质等是正确解答本题的关键.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
17.已知H2S气体与SO2气体混合可迅速反应成硫和水(2H2S+SO2═3S↓+2H2O).在一个密闭的容器内,充入a个H2S分子和b个SO2分子,充分反应后密闭容器中硫原子数和氧原子数之比是( )
| A. | $\frac{a}{b}$ | B. | $\frac{a+b}{2b}$ | C. | $\frac{2a+b}{2b}$ | D. | $\frac{2a}{a+b}$ |
1.下列变化属于化学变化的是( )
| A. | 粗盐(含不溶于水的杂质)提纯 | B. | 用金刚石刻划玻璃 | ||
| C. | 冰融化成水 | D. | 充分加热试管中的火柴头使其燃烧 |
 如图是甲、乙、并三种固体物质的溶解度曲线.
如图是甲、乙、并三种固体物质的溶解度曲线.