题目内容
硫酸铜是一种应用极其广泛的化工原料,易溶于水而不易溶于酒精;以下是某工厂用含铁废铜为原料生产胆矾(CuSO4•5H2O)和副产物石膏(CaSO4•2H2O)的生产流程示意图:
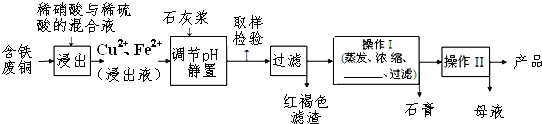
胆矾和石膏在不同温度下的溶解度(g/100g水)如表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红褐色滤渣的主要成分是 ;
(2)含铁的废铜和稀硫酸反应的化学方程式 F ;
(3)操作I最后温度应该控制在 ℃左右;
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为蒸发浓缩、 、过滤、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是 .
【分析】(1)由工艺流程图转化关系可知,红褐色滤渣的主要成分为氢氧化铁;
(2)铁和硫酸反应生成硫酸亚铁和氢气;
(3)将加热温度控制在100℃以内,采取水浴加热,受热均匀;
(4)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥.结合物质的溶解性来分析.
【解答】解:(1)由工艺流程图转化关系可知,浸出液中加入石灰浆调节pH值,铁离子转化为Fe(OH)3沉淀析出,红褐色滤渣的主要成分为Fe(OH)3.故答案为:Fe(OH)3;
(2)铁和硫酸反应生成硫酸亚铁和氢气;故填:Fe+H2SO4=FeSO4+H2↑;
(3)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,温度应该控制在100℃,制备的胆矾相对较纯.故答案为:100;
(4)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、 洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水是为了减少晶体溶解损失;故填:冷却结晶;减少因晶体溶解造成的损失.
洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水是为了减少晶体溶解损失;故填:冷却结晶;减少因晶体溶解造成的损失.

 名师点拨卷系列答案
名师点拨卷系列答案归纳推理是学习化学的重要方法之一.下列有关事实和推理得到的结论合理的是( )
| 事实 | 结论 | |
| A | 二氧化锰对氯酸钾分解和过氧化氢分解均有催化作用 | 不同的反应有时可以使用同一种物质作催化剂 |
| B | 白磷和红磷均是由磷元素组成的单质 | 白磷和红磷属于同一种物质 |
| C | C与O2反应能放出大量的热 | C与O2不需要任何条件就可以发生反应 |
| D | Al在常温下就能与O2发生发应,Fe在常温下几乎不与O2反应 | Al的抗腐蚀性能比Fe弱 |
A.A B.B C.C D.D
化学学习让我们有很多收获.下列归纳和总结完全正确的一组是
| A.对化学资源的认识 | B.对人物贡献的认识 |
| ①可用塑料来代替部分铜制造汽车零部件 ②稀土是不可再生的重要战略资源,应合 理利用和保护 | ①拉瓦锡:定量法测定空气的组成 ②张青莲:电解水法测定水的组成 |
| C.对物质俗称的认识 | D.对安全的认识 |
| ①烧碱、纯碱都是氢氧化钠 ②熟石灰、消石灰都是氢氧化钙 | ①点燃可燃性气体前一定要验纯 ②含有亚硝酸钠的工业用盐可以食用 |
( )
A.A B.B C.C D.D



 2
2