题目内容
5. 变废为宝既可避免资源浪费又可保护环境.如以含锌废渣(主要成分为Zn、ZnO、FeO、CuO)为原料可制备氯化锌,其流程如图所示:
变废为宝既可避免资源浪费又可保护环境.如以含锌废渣(主要成分为Zn、ZnO、FeO、CuO)为原料可制备氯化锌,其流程如图所示:(1)第③步的实验操作为过滤.
(2)写出流程中涉及的任意两个反应的化学方程式Zn+2HCl=ZnCl2+H2↑、ZnO+2HCl=ZnCl2+H2O.
(3)向固体C中加入稀盐酸,有气泡产生,则固体C中一定含有的物质是铁.
④实验后得到纯净ZnCl2的质量大于溶液D中溶质的质量,原因是锌和氯化亚铁反应生成了氯化锌、锌和氯化铜反应生成了氯化锌和铜.
分析 (1)根据过滤可以将不溶性固体和溶液分离进行分析;
(2)根据锌和盐酸反应生成氯化锌和氢气,氧化锌和盐酸反应生成氯化锌和水进行分析;
(3)根据锌和盐酸反应生成氯化锌和氢气,氧化锌和盐酸反应生成氯化锌和水,氧化铜和盐酸反应生成氯化铜和水,氧化亚铁和盐酸反应生成氯化亚铁和水,所以溶液A中含有氯化锌、氯化亚铁、氯化铜,锌会与氯化亚铁、氯化铜反应生成氯化锌和铜、铁,向固体C中加入稀盐酸,有气泡产生,则固体C中一定含有的物质是铁进行分析;
根据锌和氯化亚铁反应生成了氯化锌、锌和氯化铜反应生成了氯化锌和铜,所以④实验后得到纯净ZnCl2的质量大于溶液D中溶质的质量进行分析.
解答 解:(1)过滤可以将不溶性固体和溶液分离,所以第③步的实验操作为过滤;
(2)锌和盐酸反应生成氯化锌和氢气,氧化锌和盐酸反应生成氯化锌和水,化学方程式为:Zn+2HCl=ZnCl2+H2↑、ZnO+2HCl=ZnCl2+H2O;
(3)锌和盐酸反应生成氯化锌和氢气,氧化锌和盐酸反应生成氯化锌和水,氧化铜和盐酸反应生成氯化铜和水,氧化亚铁和盐酸反应生成氯化亚铁和水,所以溶液A中含有氯化锌、氯化亚铁、氯化铜,锌会与氯化亚铁、氯化铜反应生成氯化锌和铜、铁,向固体C中加入稀盐酸,有气泡产生,则固体C中一定含有的物质是铁;
锌和氯化亚铁反应生成了氯化锌、锌和氯化铜反应生成了氯化锌和铜,所以④实验后得到纯净ZnCl2的质量大于溶液D中溶质的质量.
故答案为:(1)过滤;
(2)Zn+2HCl=ZnCl2+H2↑、ZnO+2HCl=ZnCl2+H2O;
(3)铁;锌和氯化亚铁反应生成了氯化锌、锌和氯化铜反应生成了氯化锌和铜.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的提示进行解答.

练习册系列答案
相关题目
15.投放废旧电池的垃圾收集箱上应贴有的标志是( )
| A. |  | B. |  | C. |  | D. |  |
16.下列气体是空气中含量最多的物质( )
| A. | 氧气 | B. | 氮气 | C. | 氢气 | D. | 氦气 |
1.有三瓶失去标签的无色无味气体:氮气、氧气、空气.请你选择一种最简便的方法将他们区分开来.( )
| A. | 带火星的木条 | B. | 铁丝燃烧 | C. | 燃着的木条 | D. | 红磷燃烧 |
2.在一般条件下,下列物质间的转化不能一步实现的是( )
| A. | (NH4)2SO4→Na2SO4 | B. | CuSO4→Cu | C. | CaCO3→Ca(OH)2 | D. | SO2→SO3 |
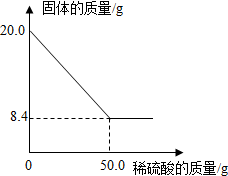 菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图所示.
菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图所示.