题目内容
某工厂欲从CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如图:
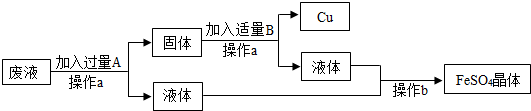
(1)操作a的名称是 .
(2)在操作b中需要用玻璃棒不断搅拌,其作用是 .
(3)写出流程中固体的成分 (写化学式),
(4)写出加入过量A时反应的化学方式: ;
(5)写出加入适量B时反应的化学方程式: .

(1)操作a的名称是
(2)在操作b中需要用玻璃棒不断搅拌,其作用是
(3)写出流程中固体的成分
(4)写出加入过量A时反应的化学方式:
(5)写出加入适量B时反应的化学方程式:
考点:金属的化学性质,过滤的原理、方法及其应用,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:根据在金属活动性顺序中,氢前的金属能与酸反应生成盐和氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,所以要回收铜得到硫酸亚铁,可以加入铁进行分析.
解答:解:(1)经过操作a能得到固体和液体,所以a操作为过滤;
(2)经过操作b得到了硫酸亚铁晶体,所以操作b是蒸发,需要用玻璃棒不断搅拌,其作用是:加快液体蒸发;
(3)过量的铁和硫酸铜反应生成硫酸亚铁和铜,所以流程中固体的成分是:Fe、Cu;
(4)加入过量A时的反应是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=FeSO4+Cu;
(5)加入适量B时的反应是铁和稀硫酸反应生成硫酸亚铁和氢气,化学方程式为:Fe+H2SO4=FeSO4+H2↑.
故答案为:(1)过滤;
(2)加快液体蒸发;
(3)Fe、Cu;
(4)Fe+CuSO4=FeSO4+Cu;
(5)Fe+H2SO4=FeSO4+H2↑.
(2)经过操作b得到了硫酸亚铁晶体,所以操作b是蒸发,需要用玻璃棒不断搅拌,其作用是:加快液体蒸发;
(3)过量的铁和硫酸铜反应生成硫酸亚铁和铜,所以流程中固体的成分是:Fe、Cu;
(4)加入过量A时的反应是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=FeSO4+Cu;
(5)加入适量B时的反应是铁和稀硫酸反应生成硫酸亚铁和氢气,化学方程式为:Fe+H2SO4=FeSO4+H2↑.
故答案为:(1)过滤;
(2)加快液体蒸发;
(3)Fe、Cu;
(4)Fe+CuSO4=FeSO4+Cu;
(5)Fe+H2SO4=FeSO4+H2↑.
点评:本题考查了铜的回收和硫酸亚铁晶体的制取,完成此题,可以依据金属活动性顺序及其意义进行解答.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
下列关于氢氧化钙的叙述中,不正确的一项是( )
| A、氢氧化钙溶液敞口放在空气中会变质 |
| B、氢氧化钙的溶解度随温度的升高而减小 |
| C、氢氧化钙可用于治疗胃酸过多 |
| D、氢氧化钙的俗名叫做熟石灰,消石灰 |
若要除去一氧化碳中混有的少量二氧化碳,最好应采用的方法是( )
| A、将混合气体点燃 |
| B、将混合气体通过澄清石灰水 |
| C、加压或降温使二氧化碳变为干冰 |
| D、将混合气体由一个容器倾倒到另一个容器里 |
下列说法符合图中漫画情景的是( )


| A、此反应可能是分解反应 |
| B、比较铁和铜的活动性强弱可以用硝酸汞溶液 |
| C、此反应可能是Cu+2HCl═H2↑+CuCl2 |
| D、若金属1是锌,金属2可能是银 |
下列有关物质用途与性质的说法正确的是( )
| A、氮气可用作保护气,说明氮气不与任何物质发生反应 |
| B、二氧化碳用于人工降雨,说明二氧化碳能灭火 |
| C、氧气能供给动植物呼吸,说明氧气具有助燃性 |
| D、金刚石可用于切割玻璃,说明金刚石硬度大 |

