题目内容
13.如图中A、B、C、D是四种粒子的结构示意图.请回答下列问题: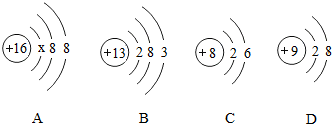
(1)A中x=2;上述四种微粒中表示离子的是粒子的AD.(填标号)
(2)由C粒子的结构示意图可知,C粒子的名称是氧原子.
(3)写出A、B、C三种元素组成的一种物质的化学式Al2(SO4)3.
分析 (1)根据粒子核外第一层上有2个电子,当质子数=核外电子数,为原子;当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子据此进行分析解答.
(2)由C粒子的结构示意图可知,质子数=核外电子数=8,为氧原子,据此进行分析解答.
(3)根据A、B、C三种元素分别是硫、铝、氧,据此进行分析解答.
解答 解:(1)粒子核外第一层上有2个电子,则x=2;A质子数=16,核外电子数=18,质子数<核外电子数,为阴离子;B质子数=核外电子数=13,为原子;C质子数=核外电子数=8,为原子;D质子数=9,核外电子数=10,质子数<核外电子数,为阴离子;
(2)由C粒子的结构示意图可知,质子数=核外电子数=8,为氧原子.
(3)A、B、C三种元素分别是硫、铝、氧,可以形成硫酸铝,化学式是:Al2(SO4)3.
故答案为:(1)2;AD;(2)氧原子;(3)Al2(SO4)3.
点评 本题难度不大,考查学生对粒子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
4.2015年10月,中国科学家屠呦呦获得诺贝尔生理学或医学奖,理由是她发现了可以有效降低疟疾患者死亡率的青蒿素.是中国医学界迄今为止获得的最高奖项,也是中医药成果获得的最高奖项.有青蒿素的化学式“C15H22O5”获得的信息正确的是( )
| A. | 青蒿素是一种化合物 | |
| B. | 青蒿素中碳、氢、氧元素的质量比为15:22:5 | |
| C. | 青蒿素中氢元素的质量分数最大 | |
| D. | 青蒿素是由碳原子、氧原子、氢原子构成的 |
1.我国著名的闽籍制碱专家侯德榜,在纯碱制造方面做出了重大贡献.用“侯氏制碱法”制得的纯碱中常含有氯化钠等杂质,化学兴趣小组欲对某品牌纯碱样品中碳酸钠的质量分数进行实验探究,在老师的指导下,他们设计了下列两种实验方案进行试验.
资料摘要:
Ⅰ.碳酸钠和氯化钙能发生复分解反应.
Ⅱ.浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳.
[方案一]样品与氯化钙溶液反应,测定Na2CO3的质量分数
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
(2)分析滴加的CaCl2溶液要过量的原因:使碳酸钠完全反应;
(3)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量.利用沉淀物质量计算Na2CO3的质量分数为91%.如果不洗涤沉淀物会造成测定结果大于91%,这是因为沉淀物上会附着一些杂质.
[方案二]样品与稀盐酸反应,测定Na2CO3的质量分数
利用下图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的).

(4)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
(5)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应),装置A中样品产生气体的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(6)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿.根据质量守恒 定律,装置C(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数.若没有装置D,将会使测定结果偏大(选填“偏大”或“偏小”).
资料摘要:
Ⅰ.碳酸钠和氯化钙能发生复分解反应.
Ⅱ.浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳.
[方案一]样品与氯化钙溶液反应,测定Na2CO3的质量分数
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl |
(3)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量.利用沉淀物质量计算Na2CO3的质量分数为91%.如果不洗涤沉淀物会造成测定结果大于91%,这是因为沉淀物上会附着一些杂质.
[方案二]样品与稀盐酸反应,测定Na2CO3的质量分数
利用下图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的).

(4)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
(5)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应),装置A中样品产生气体的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(6)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿.根据质量守恒 定律,装置C(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数.若没有装置D,将会使测定结果偏大(选填“偏大”或“偏小”).
8.下列说法中正确的是( )
| A. | 氯化钠的构成粒子是Na+和Cl- | |
| B. | 含有氧元素的化合物是氧化物 | |
| C. | 原子核是由质子和电子构成的 | |
| D. | NH3由一个氮元素和三个氢元素组成 |
18.能说明纸张燃烧是化学变化的是( )
| A. | 发光 | B. | 放热 | C. | 生成二氧化碳 | D. | 纸张的面积变小 |
2.实验室里用二氧化锰作催化剂,加热氯酸钾制取氧气.若忘记加入二氧化锰,其结果是( )
| A. | 不能产生氧气 | B. | 产生氧气的速率慢 | ||
| C. | 产生氧气的总量减少 | D. | 没有氯化钾生成 |