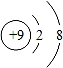题目内容
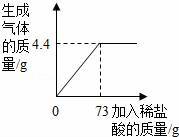
某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图,发生反应:
Na2CO3+2HCl=2NaCl+CO2↑+H2O
(1)生成CO2的质量为 g.
(2)计算该样品中含碳酸钠的质量分数是多少?(计算结果保留一位小数)

【考点】根据化学反应方程式的计算.
【专题】综合计算(图像型、表格型、情景型计算题).
【分析】(1)由图示可知生成的二氧化碳的质量;
(2)根据化学方程式由二氧化碳的质量可以求出碳酸钠的质量,进而可以求出样品中碳酸钠的质量分数.
【解答】解:(1)由图示可知生成的二氧化碳的质量为4.4g;
故答案为:4.4;
(2)解:设样品中含Na2CO3的质量为x
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
x 4.4g
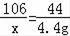

x=10.6g
该样品中含碳酸钠的质量分数为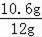
 ×100%=88.3%
×100%=88.3%
答:该样品中含碳酸钠的质量分数为88.3%.
【点评】本题难度不大,掌握根据化学方程式与质量分数的综合计算即可正确解答本题.

 计算高手系列答案
计算高手系列答案








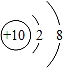 B.
B.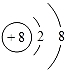 C.
C.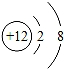 D.
D.