题目内容
二氧化碳是导致温室效应的主要气体,也是一种宝贵的资源,用CO2和NH3来合成尿素[CO(NH2)2]是固定和利用CO2的成功范例,其反应的化学方程式为:
CO2+2NH3 CO(NH2)2+H2O
CO(NH2)2+H2O
请计算下列问题:
(1)若利用CO2和NH3生产900t尿素,理论上可固定CO2的质量是多少吨?
(2)2t含尿素90%的化肥(杂质不含N)中,含氮元素的质量是多少吨?(精确到0.1t).
(1)660t;(2)0.84t
【解析】
试题分析:(1)设生产1000万吨尿素需要二氧化碳的质量为x,
CO2+2NH3 CO(NH2)2+H2O
CO(NH2)2+H2O
44 60
x 900t
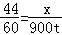
x=660t
(2)经测定某尿素样品含尿素90%,2t该样品中尿素的质量为2×90%=1.8t
其中含氮元素的质量为1.8t××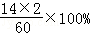 =0.84t
=0.84t
答:(1)理论上可固定CO2的质量是660t(2)含氮元素的质量是0.84t
考点:根据化学反应方程式的计算;混合物中某元素的质量计算

练习册系列答案
相关题目
除去下列物质中的杂质,所选用的试剂或操作方法有错误的是( )
选项 | 物质 | 杂质(少量) | 试 剂 | 操作方法 |
A | N2 | O2 | 铜网 | 将混合气体缓缓通过灼热的铜网 |
B | KCl | K2CO3 | 盐酸 | 加入过量的盐酸、蒸发 |
C | KNO3 | NaCl | 热水 | 溶解、降温结晶、过滤 |
D | MnO2 | K2MnO4 | 足量的水 | 溶解、过滤、蒸发 |

