题目内容
13.为了测定某粉末状黄铜(铜,锌合金)样品中铜的质量分数,甲同学取了39g黄铜样品放入烧杯中,再取500g稀盐酸分五次加入烧杯中,均充分反应,实验数据如下:| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入稀盐质量(g) | 100 | 100 | 100 | 100 | 100 |
| 烧杯内物质总质量(g) | 138.8 | 286.6 | n | 438.2 | 538.2 |
(2)求样品中锌的质量(x)的比例式$\frac{65}{2}$=$\frac{x}{0.8g}$;
(3)黄铜样品中铜、锌质量比$\frac{1}{2}$;
(4)若工业上用含Cu2S 70%的辉铜矿冶炼上述黄铜756t,需要辉铜矿的质量为500t(假设炼制过程中辉铜矿的利用率为90%)
分析 (1)根据金属活动性可知,铜排在氢后,不能与稀盐酸发生反应,故发生反应的是锌,可写化学反应方程式;
(2)根据质量守恒定律可知:反应前后减少的质量就是生成的氢气的质量,则由表中的数据对比分析可知:每100g盐酸完全与锌反应生成了139g-138.8g=0.2g氢气,由于第四次、第五次加入的100g盐酸均产生了0.2g氢气,说明第四次锌完全参加反应,根据氢气的质量可列出样品中锌的质量(x)的比例式;
(3)根据上述比例式求出锌的质量再求出黄铜样品中铜、锌质量比;
(4)根据黄铜中铜的质量分数可以计算炼制出黄铜的质量,进而计算出需要辉铜矿的质量.
解答 解:(1)锌能与盐酸反应生成氯化锌与氢气,方程式为:Zn+2HCl═ZnCl2+H2↑;
(2)根据质量守恒定律可知:反应前后减少的质量就是生成的氢气的质量,则由表中的数据对比分析可知:每100g盐酸完全与锌反应生成了139g-138.8g=0.2g氢气,由于第四次、第五次加入的100g盐酸均产生了0.2g氢气,说明第四次锌完全参加反应,锌完全反应生成氢气的质量为0.8g.
设样品中锌的质量为x
Zn+2HCl═ZnCl2+H2↑
65 2
x 0.8g
$\frac{65}{2}$=$\frac{x}{0.8g}$
解得:x=26g
(3)黄铜样品中铜、锌质量比为:$\frac{39g-26g}{26g}$=$\frac{1}{2}$;
(4)设需要辉铜矿的质量为y,由题意可列出计算式:x×90%×70%×$\frac{128}{160}$×100%=756t×$\frac{1}{3}$,解得x=500t;
故答案为:(1)Zn+2HCl═ZnCl2+H2↑;(2)$\frac{65}{2}$=$\frac{x}{0.8g}$;(3)$\frac{1}{2}$;(4)500t.
点评 根据所给的实验数据分析每次加入100g稀盐酸烧杯内剩余物质量的变化,可对反应进行的情况进行判断,并明确参加反应的是固体中的锌,这是解决本题的关键.

(1)将6.62g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH溶液,充分反应后,过滤、洗涤、灼烧得4.80g Fe2O3.现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石1.97吨(结果保留两位小数).
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到lg白色沉淀.
①计算此钢样粉末中铁和碳的质量之比.
②再取三份不同质量的钢样粉末分别加到50g质量分数相同的稀H2SO4中,充分反应后,测得的实验数据如了表所示(标准状况下,2g H2的体积为22.4L):
| 实验序号 | I | Ⅱ | Ⅲ |
| 加入钢禅的粉末的质量/g | 2.812 | 5.624 | 8.436 |
| 生成气体的体积/g(标况下) | 1.120 | 2.240 | 2.800 |
③若在实验Ⅱ中继续加入mg钢样粉末,请用含m的代数式表示反应结束后剩余的全部固体质量为(只写出最后结果即可)当m>1.406g,剩余固体质量为:(m-1.376)g;
当m≤1.406g,剩余固体质量为:(5.624+m)×$\frac{0.12g}{28.12g}$g.
| A. | 氢氧化镁和稀盐酸 | B. | 二氧化碳和石灰水 | ||
| C. | 氯化钾溶液和硝酸钠溶液 | D. | 锌和硫酸 |
| A. | 本药品对人体无任何副作用 | |
| B. | 长期饮用纯净水有益身体健康 | |
| C. | 吸带过滤嘴的香烟对人体无害 | |
| D. | 节日庆祝大量燃放烟花爆竹会造成空气的污染 |
| A. |  | B. |  | C. |  | D. |  |
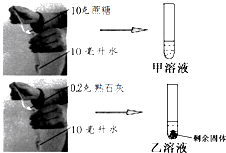 小明同学为探究物质的溶解性进行如图实验,图中环境温度为20℃,从图中数据分析可知:
小明同学为探究物质的溶解性进行如图实验,图中环境温度为20℃,从图中数据分析可知: