题目内容
9.小组在实验室进行关于气体的实验,所用的部分仪器如图所示.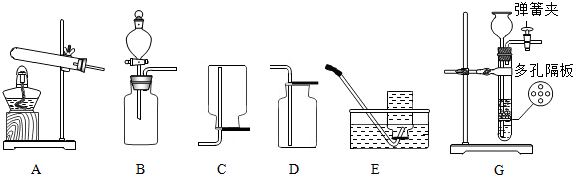
(1)甲同学用双氧水制取氧气,发生反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,选择的收集装置是D或E.
(2)该同学发现产生的气体能使带火星的木条复燃并有刺激性气味,下列分析不合理的是a.
a.反应中氧气的物理性质发生了变化 b.此时得到的气体一定是混合物
c.只加热氯酸钾,若生成的气体无气味,说明刺激性气味一定与二氧化锰有关
d.可能是生成的氧气与残留在发生装置中的空气在加热的条件下反应生成了新物质.
(3)如图G装置也可制取二氧化碳气体,制取二氧化碳的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.G装置的优点是可随时控制反应的发生和停止.若打开弹簧夹,固体与液体接触,反便能发生,请简述使G装置中反应停止的操作关闭弹簧夹,试管内压强增大,固体与液体分离.
分析 制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.
解答 解:(1)如果用双氧水和二氧化锰制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,要注意配平;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;E;
(2)该同学发现产生的气体能使带火星的木条复燃并有刺激性气味,下列分析不合理的是:反应中氧气的物理性质发生了变化;故答案为:a;
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;使G装置中反应停止的操作:关闭弹簧夹,试管内压强增大,固体与液体分离;故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;关闭弹簧夹,试管内压强增大,固体与液体分离;
点评 本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.一定温度下,在质量都是50克的五杯水中分别加入30克、40克、50克、60克、70克硝酸钾固体,充分搅拌后,滤去未溶解的硝酸钾.加入的硝酸钾质量与相应所得溶液的质量数据见下表:硝酸钾的溶解度( )
| 加入的硝酸钾质量/克 | 30 | 40 | 50 | 60 | 70 |
| 所得溶液的质量/克 | 80 | 90 | 100 | 105 | 105 |
| A. | 55克 | B. | 80克 | C. | 105克 | D. | 110克 |
4.下列四个图象中,能正确表示反应对应变化关系的是( )
| A. |  向一定量稀盐酸中加水稀释 | |
| B. |  一定温度下,不饱和氯化钠溶液中加入氯化钠 | |
| C. |  室温时,向一定量的稀盐酸中加入少量镁条 | |
| D. |  用等质量、等浓度的双氧水分别制取氧气 |
1.氧化汞受热时的变化可用下图表示(图中大圆圈表示汞原子,小圆圈表示氧原子).据图得出的错误结论是( )


| A. | 氧化汞受热时能分解成汞和氧气 | B. | 原子是化学变化中的最小粒子 | ||
| C. | 分子在化学变化中可以再分 | D. | 所有的物质都是由分子构成 |
18.在高空中有一层臭氧层,它吸收了太阳光中的绝大部分的紫外线,使地球上的生物免受紫外线的伤害.臭氧的化学式是O3,下列关于臭氧的说法正确的是( )
| A. | 臭氧由3个氧元素组成 | B. | 臭氧由3个氧原子构成 | ||
| C. | 臭氧是单质 | D. | 臭氧是化合物 |
19. 如图是某化学反应前后反应物与生成物分子及其数目变化的微观示意图,其中不同的圆球代表不同的原子.下列说法正确的是( )
如图是某化学反应前后反应物与生成物分子及其数目变化的微观示意图,其中不同的圆球代表不同的原子.下列说法正确的是( )
 如图是某化学反应前后反应物与生成物分子及其数目变化的微观示意图,其中不同的圆球代表不同的原子.下列说法正确的是( )
如图是某化学反应前后反应物与生成物分子及其数目变化的微观示意图,其中不同的圆球代表不同的原子.下列说法正确的是( )| A. | 该反应中,生成物是一种化合物和一种单质 | |
| B. | 该反应中,参加反应的两种分子个数比为5:1 | |
| C. | 反应前后,原子的种类与数目都发生了改变 | |
| D. | 该反应中,生成物只有一种化合物 |