题目内容
16.生物浸出技术在金属冶炼中应用广泛,嗜热细菌在65~80℃酸性水溶液及氧气存在下,能氧化黄铜矿(主要成分)产生硫酸盐,进而生产铜和绿矾,主要流程如图: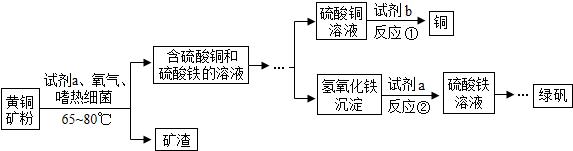
(1)试剂a是H2SO4(填化学式),分离出矿渣的操作是过滤.
(2)若试剂b为Fe粉,反应①的化学方程式为Fe+CuSO4═FeSO4+Cu.
(3)该流程中除了产生硫酸盐外还会产生一种含硫的有毒气体,流程中主要涉及的化学方程式为CuFeS2+2a═CuSO4+FeSO4+2H2S.在实验室中常用NaOH溶液酸碱中和这一有毒气体,其化学方程式为:H2S+2NaOH=Na2S+2H2O.
分析 (1)黄铜矿粉和a反应生成硫酸铜和硫酸铁,氢氧化铁和a反应生成硫酸铁,说明a是硫酸;
过滤能够把不溶于水的固体从液体中分离出来;
(2)铁和硫酸铜反应生成硫酸亚铁和铜;
(3)化学反应前后,元素的种类不变,原子的种类、总个数不变.
解答 解:(1)试剂a是H2SO4,分离出矿渣的操作是过滤.
故填:H2SO4;过滤.
(2)若试剂b为Fe粉,反应①中铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu.
故填:Fe+CuSO4═FeSO4+Cu.
(3)由反应可知,反应前后铜原子都是1个,铁原子都是1个,氧原子都是8个,反应前硫原子是4个,反应后应该是4个,其中1个包含在未知生成物中,反应前氢原子是4个,反应后应该是4个,其中2个包含在未知生成物中,因此未知生成物的化学式是H2S;
在实验室中常用NaOH溶液酸碱中和H2S,氢氧化钠和H2S反应生成硫化钠和水,其化学方程式为:H2S+2NaOH=Na2S+2H2O.
故填:H2S;H2S+2NaOH=Na2S+2H2O.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列物质属于纯净物的是( )
| A. | 硬铝 | B. | 天然气 | C. | 盐酸 | D. | 氮气 |
7.硫原子的相对原子质量是( )
| A. | 32 g | B. | 32 | C. | 5.314×10-26 kg | D. | 32 kg |
11. 小华设计了一个电解水的简易装置(如图所示),电解一段时间后的现象如图所示.对该实验的描述错误的是( )
小华设计了一个电解水的简易装置(如图所示),电解一段时间后的现象如图所示.对该实验的描述错误的是( )
 小华设计了一个电解水的简易装置(如图所示),电解一段时间后的现象如图所示.对该实验的描述错误的是( )
小华设计了一个电解水的简易装置(如图所示),电解一段时间后的现象如图所示.对该实验的描述错误的是( )| A. | 甲试管中收集到的是一种可燃性气体 | |
| B. | 该实验能证明水是由氢元素和氧元素组成 | |
| C. | 向水中加入少量硫酸钠溶液,能增强水的导电性 | |
| D. | 甲、乙两试管内收集到的气体的质量比约为8:1 |
1.检验集气瓶中的CO2是否收集满的正确方法是( )
| A. | 向瓶内倒入澄清石灰水振荡 | B. | 在瓶口闻其气味 | ||
| C. | 将带火星的木条插入瓶里 | D. | 将燃着的木条放在瓶口 |
6.如图是水分子在一定条件下分解的示意图,从中获得的信息不正确的是( )


| A. | 水分解后生成氢气和氧气的分子数目比为2:1 | |
| B. | 水分解过程中,原子的数目不变 | |
| C. | 一个水分子由二个氢原子和一个氧原子构成 | |
| D. | 水分解过程中,分子的种类不变 |
