题目内容
15. 现有两种金属单质组成的混合物.向100g某稀盐酸(足量)中加入该混合物,混合物的质量与生成氢气的质量关系如图所示.下列说法正确的是( )(填序号)
现有两种金属单质组成的混合物.向100g某稀盐酸(足量)中加入该混合物,混合物的质量与生成氢气的质量关系如图所示.下列说法正确的是( )(填序号)| A. | 若混合物为Zn、Al,则m可能是0.2 | |
| B. | 若混合物为Zn、Cu,则m可能是0.2 | |
| C. | 若混合物为Fe、Al,则稀盐酸中溶质质量分数可能是7.3% | |
| D. | 若混合物为Fe、Cu,m为0.1 g,则该混合物中Fe的质量分数一定是50% |
分析 锌、铝和铁与稀盐酸反应生成氢气和相应的盐,铜不能和稀盐酸反应,根据反应的化学方程式及其物质的相对分子质量可以计算判断相关方面的问题.
解答 解:A、锌、铝与稀盐酸反应的化学方程式及其质量关系为:Zn+2HCl═ZnCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,
65 2 54 6
由质量关系可知,产生0.2g氢气时消耗锌的质量是6.5g,消耗铝的质量是1.8g,因此若混合物为Zn、Al,则m可能是0.2;
B、产生0.2g氢气时消耗锌的质量是6.5g,铜不能稀盐酸反应,因此若混合物为Zn、Cu,则m小于0.2;
C、铁、铝和稀盐酸反应的化学方程式及其质量关系为:Fe+2HCl═FeCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,
56 73 54 219
由质量故选可知,如果全部是铁,5.6g铁和7.3g氯化氢恰好完全反应,这时稀盐酸中溶质质量分数是7.3%,如果全部是铝,5.6g铝消耗氯化氢质量大于7.3g,这时稀盐酸中溶质质量分数大于7.3%,若混合物为Fe、Al,则稀盐酸中溶质质量分数大于7.3%;
D、若混合物为Fe、Cu,m为0.1 g,则该混合物中铁的质量是2.8g,则铁的质量分数一定是50%.
故选:AD.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算判断时要注意规范性和准确性.

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案| A. | 0 | B. | -2 | C. | -1 | D. | +1 |
| 可燃气体 | 爆炸极限(体积分数) |
| PX蒸汽 | 1.1%~6.6% |
| CH4 | 5%~15% |
| 酒精蒸汽 | 3.3%~19% |
| H2 | 4.0%~74.2% |
(2)上述性质属于PX物理性质的是①③④(填序号).
(3)PX泄露引起的火灾,不能(填“能”或“不能”)用水灭火.
(4)表是四种气体的爆炸极限,请你据此判断:最容易发生爆炸的气体是氢气.
(5)写出PX在空气中完全燃烧的化学方程式:2C8H10+21O2$\frac{\underline{\;点燃\;}}{\;}$16CO2↑+10H2O.
| A. | 18O 的相对原子质量为 $\frac{12b}{a}$ | |
| B. | 12C与18O的相对原子质量之比为2:3 | |
| C. | 18 g 18O 中质子的质量约为 9g | |
| D. | 1 个由 12C 和 18O 组成的 CO2分子含 22 个电子,26 个中子 |
| A. | a+b-c | B. | a+b+c | C. | $\frac{177}{44}$(a+b-c) | D. | $\frac{44}{177}$(a+b-c) |
①通过灼热的氧化铜 ②观察颜色 ③通入紫色石蕊溶液
④伸入燃着的木条 ⑤闻气味 ⑥通入澄清的石灰水.
| A. | ①②③④ | B. | ②③④⑥ | C. | ①③④⑥ | D. | ①②③④⑤⑥ |
| A. | 灯芯温度太高会使玻璃熔化破裂 | |
| B. | 造成酒精大量挥发浪费 | |
| C. | 灯芯温度低,会使玻璃受热不均而破裂 | |
| D. | 酒精灯会熄灭 |
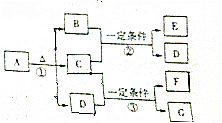 A-G7种物质之间的转化关系如图所示,且B、C、G在常温下是气体,D是液体,E、F是有机物,F的相对分子质量是E的3倍.A的相对分子质量是79.E中的4种元素的原子个数比为1:1:2:4
A-G7种物质之间的转化关系如图所示,且B、C、G在常温下是气体,D是液体,E、F是有机物,F的相对分子质量是E的3倍.A的相对分子质量是79.E中的4种元素的原子个数比为1:1:2:4