题目内容
8.(1)下列氮肥含氮量由高到低是排列顺序是:③①② (用序号表示)| 常见氮肥 | ①NH4NO3 | ②NH4HCO3 | ③CO(NH2)2 |
| 相对分子质量 | 80 | 79 | 60 |
(3)有机物中碳氢化合物可用CxHy表示,其完全燃烧的化学方程式:CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O.判断等质量的①CH4,②C2H2,③C2H4,三种碳氢化合物完全燃烧消耗氧气由大到小的顺序是①③②.(用序号表示)
分析 (1)根据化合物中元素的质量分数的计算方法来分析解答.
(2)根据一氧化碳和一氧化氮经过催化作用生成二氧化碳和氮气进行分析;
(3)根据化学方程式来分析解答.
解答 解:(1)解:在硝酸铵中,NH4NO3-----2N
80 28
在碳酸氢铵中,2NH4HCO3-----2N
158 28
在尿素中,CO(NH2)2------2N
60 28
由此可见,尿素中氮元素的含量最高,碳酸氢铵中氮元素的含量最低.故填:③①②.
(2)一氧化碳和一氧化氮在催化剂的条件下生成氮气和二氧化碳,化学反应方程式是:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.故填:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2;
(3)设:三种物质的质量均为x,
①甲烷完全燃烧需要氧气的质量为a,CH4燃烧的方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O
16 64
x a
$\frac{16}{64}=\frac{x}{a}$ a=4x
②C2H2完全燃烧需要氧气的质量为b,燃烧的方程式为:2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O
52 160
x b
$\frac{52}{160}=\frac{x}{b}$ b=$\frac{40}{13}$x
③C2H4完全燃烧需要氧气的质量为c,燃烧的方程式为:C2H4+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2H2O
28 96
x c
$\frac{28}{96}=\frac{x}{c}$ c=$\frac{24}{7}x$
故填:①③②
点评 本题难度不大,考查同学们灵活运用化学式和化学方程式的有关计算进行分析问题、解决问题的能力.要注意用简便的方法来解决实际问题.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案(1)图1所示用品中,利用金属导电性的是B(填字母序号).
(2)下表是一些金属的熔点数据.

| 金属 | 铜 | 锌 | 锡 | 铅 | 铋 | 镉 |
| 熔点/℃ | 1083 | 419.6 | 231.9 | 327.5 | 271.3 | 320.9 |
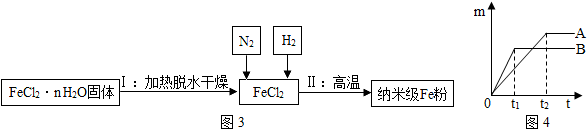
(3)新型材料纳米级Fe粉在空气中易自燃,能用作高效催化剂,实验室采用还原法制备纳米级Fe粉,流程如图3:
①铁丝在空气中只能灼成红热、离火变冷,而纳米级Fe粉在空气中易自燃,说明物质燃烧的剧烈程度与药品的状态(可燃物与氧气的接触面积)有关.
②写出Ⅱ中用氢气从FeCl2置换出铁的反应方程式H2+FeCl2$\frac{\underline{\;高温\;}}{\;}$Fe+2HCl.
在Ⅱ中通入氮气的目的是排尽空气,防止生成的铁粉被反应.
(4)一般情况下,两种活动性不同的金属在潮湿的环境中接触时,活动性较强的金属首先被腐蚀.造船工业为避免轮船的钢铁外壳被腐蚀,通常在轮船外壳镶嵌的金属是D.(填编号)
A、银块 B、铜块 C、锡块 D、锌块
(5)用下列试剂探究不同金属与酸反应的速率不同:锌片、铁片、5%盐酸.取质量相等的上述两种金属(表面积相同),分别放入溶质质量分数5%的足量稀盐酸中.
①线B对应的金属是Zn.
②线A对应的金属与稀盐酸反应的化学方程式Fe+2HCl═FeCl2+H2↑.
(6)某兴趣小组的同学将一块不纯的铁片5.6g投入到足量的稀盐酸中,充分反应后生成了0.2g气体,则该铁片中混有的杂质一定不可能是D.
A、铝和锌 B、镁和锌 C、镁和铜 D、锌和铜.
| A. | 生石灰、烧碱、浓硫酸都可以用作干燥剂 | |
| B. | 铁、锌、碘元素都属于人体必需微量元素 | |
| C. | CH4、C2H5OH、CH3COOH 都属于有机化合物 | |
| D. | KNO3、CO(NH2)2、NH4H2PO4 都属于复合肥料 |
| A. | 电子数 | B. | 质子数 | C. | 中子数 | D. | 最外层电子数 |
| A. | H2SiO3 | B. | SiO2 | C. | Si | D. | SiH4 |
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
 A、B、C、D分别为氧化铁、盐酸、氢氧化钙、碳酸钙中的一种.它们之间的反应或转化关系如图(部分物质和反应条件已略去).则化学方程式:①Ca(OH)2+CO2=CaCO3↓+H2O;②Fe2O3+6HCl=2FeCl3+3H2O;A在生产或生活中的一种用途是改良酸性土壤.
A、B、C、D分别为氧化铁、盐酸、氢氧化钙、碳酸钙中的一种.它们之间的反应或转化关系如图(部分物质和反应条件已略去).则化学方程式:①Ca(OH)2+CO2=CaCO3↓+H2O;②Fe2O3+6HCl=2FeCl3+3H2O;A在生产或生活中的一种用途是改良酸性土壤.