题目内容
(2012•盐城)某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.
[查阅资料]
|
名称 |
食用纯碱 |
食用小苏打 |
|
主要成分 |
Na2CO3 |
NaHCO3 |
|
酸碱性 |
水溶液显碱性 |
水溶液显碱性 |
|
热稳定性 |
受热不分解 |
270℃时完全分解为碳酸钠、二氧化碳、水 |
(1)探究两者水溶液酸碱性的差异
小明分别向等浓度的两种溶液中滴入酚酞试液,发现两者都变 色,但食用纯碱溶液中颜色更深,由此推测可能 溶液碱性更强.小欢认为要比较两种溶液的碱性强弱,可直接用 进行测定.
(2)验证两种粉末的稳定性
在老师的指导下,该小组按如图1装置进行实验操作,观察到 (填“甲”或“乙”)烧杯中澄清石灰水变浑浊,试管中发生反应的化学方程式为 ,装置中棉花的作用是 .
(3)测定食用纯碱粉末的纯度
取食用纯碱粉末试样,利用如图2装置进行实验测定.

数据记录如下:
|
称量项目 |
称量时间 |
质量/g |
|
试样 |
|
11.0 |
|
装置+稀盐酸 |
|
160.0 |
|
装置+稀盐酸+试样 |
反应开始后20s |
167.0 |
|
装置+稀盐酸+试样 |
反应开始后30s |
166.6 |
|
装置+稀盐酸+试样 |
反应开始后90s |
166.6 |
②通过计算确定食用纯碱粉末中Na2CO3的质量分数.(写出计算过程,结果保留一位小数.)
③如果测得的结果比实际纯度高,可能的原因是 .(答一种即可)
(1)红;食用纯碱(或Na2CO3);pH试纸;
(2)乙; 2NaHCO3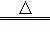 Na2CO3+CO2↑+H2O;防止加热时小苏打(或NaHCO3)粉末进入导管;
Na2CO3+CO2↑+H2O;防止加热时小苏打(或NaHCO3)粉末进入导管;
(3)①4.4;②食用纯碱粉末中Na2CO3的质量分数为96.4%;③稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测纯度偏大.(或水蒸气随CO2气体排出,从而导致所测纯度偏大)
【解析】(1)从表中可以看出食用纯碱和食用小苏打的水溶液均显碱性,遇酚酞均能使酚酞变红,且碱性越强颜色越红,测定溶液酸碱性强弱程度可采用pH试纸或PH计完成;
(2)由图表关于两者的热稳定性进行分析可知:食用小苏打可以加热分解生成二氧化碳,而食用纯碱不能,所以分析装置可知乙烧杯的澄清石灰水变浑浊,其分解方程式为:2NaHCO3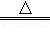 Na2CO3+CO2↑+H2O,装置中的棉花团的作用是:防止加热时小苏打(或NaHCO3)粉末进入导管;
Na2CO3+CO2↑+H2O,装置中的棉花团的作用是:防止加热时小苏打(或NaHCO3)粉末进入导管;
(3)①由图表数据分析可知11g样品与盐酸完全反应的质量变化是(11g+160g)﹣166.6g=4.4g,因为此过程发生的反应是Na2CO3+2HCl=2NaCl+H2O+CO2↑,所以此质量差即是生成二氧化碳的质量;
②设生成4.4g二氧化碳时需要碳酸钠的质量是x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
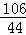 =
=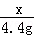
x=10.6g
所以食用纯碱粉末中Na2CO3的质量分数为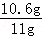 ×100%≈96.4%;
×100%≈96.4%;
③通过以上计算可知如果测得的结果比实际纯度高,则是测量的二氧化碳质量比实际值偏大,可能的原因是稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测纯度偏大

 ,下列说法错误的是( )
,下列说法错误的是( )