题目内容
19.某工厂欲从只含有硫酸铜的废液中回收金属铜,并得到工业原料硫酸亚铁晶体,其流程如下:
①操作a的名称是过滤.
②流程中固体的成分是铁和铜,反应1的化学方程式为Fe+CuSO4=FeSO4+Cu.
③液体A和液体B中含有相同的溶质,其化学式是FeSO4;判断反应2中加入的稀硫酸“适量”的方法是无气泡产生.
分析 (1)依据操作a分离出的产物状态判断操作的名称;
(2)根据金属活动性顺序的应用,结合加入过量的铁粉分析判断;
(3)依据酸能与铁反应生成氢气解答即可.
解答 解:(1)由图示可以看出操作a分离出的产物状态都是溶液和固体,因此操作的名称为过滤,故填:过滤;
(2)由于活动性强的金属可以把活动性弱的金属从其盐溶液中置换出来,所以根据铁的活动性比铜强,可知铁会置换出硫酸铜中的铜,因此固体是铜和未反应的铁粉的混合物,故填:铜和铁,Fe+CuSO4=FeSO4+Cu;
(3)铁能与硫酸铜反应生成硫酸亚铁,故溶液A是硫酸亚铁,铁的活动性在氢前,所以可以与稀硫酸反应生成硫酸亚铁,所以溶液B为硫酸亚铁溶液,判断反应2中加入的稀硫酸“适量”的方法是无气泡产生,故填:FeSO4,无气泡产生.
点评 此题属于分离提纯物质的推断题,掌握常见的分离物质的方法结合有关金属活动性顺序的具体应用是解题的关键.

练习册系列答案
相关题目
9.分类是学习化学的方法之一.下列物质分类错误的是( )
| A. | 水银:金属 | B. | 纯碱:碱 | C. | 空气:混合物 | D. | 干冰:氧化物 |
10.工业上生产硫酸的第一步反应为:4X+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,则X为( )
| A. | FeS2 | B. | Fe2S3 | C. | FeSO4 | D. | FeS |
7.厨房中物质加入适量水后不能形成溶液的是( )
| A. | 食盐 | B. | 蔗糖 | C. | 植物油 | D. | 纯碱 |
14.下列图象能正确反映对应变化关系的是( )
| A. | 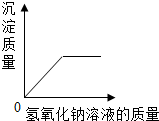 向一定量硫酸铜和硫酸混合液滴入氢氧化钠 | |
| B. | 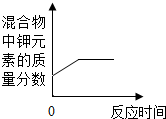 加热一定量氯酸钾 和二氧化锰混合物 | |
| C. | 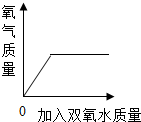 向盛有少量二氧化锰的 烧杯中不断加入双氧水 | |
| D. | 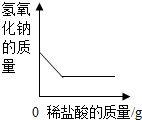 向一定量氢氧化钠溶液中滴入稀盐酸 |
4.新型材料的出现是材料发展史的重大突破.下列应用的材料属于复合材料的是( )
| A. |  玻璃钢茶几 | B. |  人面鱼纹彩陶盆 | C. |  金刚石薄膜 | D. |  银制器皿 |
11.下列图象与所对应操作相符的是( )
| A. |  20℃时,把少量氧化钙固体放入饱和氢氧化钙溶液中 | |
| B. |  向两份相等质量、相等溶质质量分数的稀硫酸中,分别加入过量的金属Mg和Al | |
| C. |  用相等质量、相等溶质质量分数的双氧水分别制取O2 | |
| D. |  向稀盐酸和氯化铜的混合溶液中加入过量的NaOH溶液 |