题目内容
将V1 mL 3.65% HCl溶液逐滴滴入盛有V2mL未知浓度的NaOH溶液的烧杯中(图1),测量并记录溶液的pH变化(图2)和温度变化(图3).(实验中始终保持 V1+V2=50.0mL且各种溶液密度均为1.0g/mL).

(1)图2中V1=0mL时,图1中烧杯内溶液的颜色显 色;
(2)实验中发生反应的化学方程式为 ;
(3)图2中的pH=7时,此时滴入的HCl溶液的体积V1= mL;
(4)通过该实验给出的判断,其中正确的是 ;
A.进行该实验时环境温度为22℃
B.该实验表明化学能可转化为热能
C.该实验表明有水生成的反应都是放热反应
D.溶液由碱性转变为中性,再转变为酸性且酸性不断减弱
(5)实验中所用NaOH溶液的溶质质量分数为 .

(1)图2中V1=0mL时,图1中烧杯内溶液的颜色显
(2)实验中发生反应的化学方程式为
(3)图2中的pH=7时,此时滴入的HCl溶液的体积V1=
(4)通过该实验给出的判断,其中正确的是
A.进行该实验时环境温度为22℃
B.该实验表明化学能可转化为热能
C.该实验表明有水生成的反应都是放热反应
D.溶液由碱性转变为中性,再转变为酸性且酸性不断减弱
(5)实验中所用NaOH溶液的溶质质量分数为
考点:中和反应及其应用,有关溶质质量分数的简单计算,酸碱指示剂及其性质,书写化学方程式、文字表达式、电离方程式,根据化学反应方程式的计算
专题:常见的酸 酸的通性
分析:(1)根据酸碱性来确定溶液的颜色;
(2)氢氧化钠与稀盐酸反应原理正确书写化学方程式;
(3)根据图示信息解答;
(4)根据实验的现象和原理解答;
(5)根据反应中消耗稀盐酸的质量来计算氢氧化钠的质量分数;
(2)氢氧化钠与稀盐酸反应原理正确书写化学方程式;
(3)根据图示信息解答;
(4)根据实验的现象和原理解答;
(5)根据反应中消耗稀盐酸的质量来计算氢氧化钠的质量分数;
解答:解:(1)图2中V1=0mL时,图1中烧杯内溶液显碱性,碱能使酚酞变红;
(2)实验中发生反应的化学方程式为:HCl+NaOH═NaCl+H2O;
(3)图3中的信息可知溶液温度最高时为酸碱恰好完全反应,溶液显中性pH=7,此时滴入的HCl溶液的体积V1=30ml;
(4)A.进行该实验时环境温度为22℃,不正确,由图示3中信息可知V1=5mL时温度为22℃,;
B.该实验中的化学反应放出热量故表明化学能可转化为热能;
C.该化学反应生成了水,但不能代表只要生成水的反应都放热;
D.该反应中溶液由碱性转变为中性,再转变为酸性且酸性不断增强;
(5)设,所用NaOH溶液的溶质质量为x,
消耗盐酸溶液中溶质的质量为:30ml×1.0g/ml×3.65%=1.095g
HCl+NaOH═NaCl+H2O;
36.5 40
1.095g x
=
x=1.2g
实验中所用NaOH溶液的溶质质量分数为:
×100%=6.0%
答案:(1)红
(2)HCl+NaOH═NaCl+H2O
(3)30
(4)B
(5)6.0%
(2)实验中发生反应的化学方程式为:HCl+NaOH═NaCl+H2O;
(3)图3中的信息可知溶液温度最高时为酸碱恰好完全反应,溶液显中性pH=7,此时滴入的HCl溶液的体积V1=30ml;
(4)A.进行该实验时环境温度为22℃,不正确,由图示3中信息可知V1=5mL时温度为22℃,;
B.该实验中的化学反应放出热量故表明化学能可转化为热能;
C.该化学反应生成了水,但不能代表只要生成水的反应都放热;
D.该反应中溶液由碱性转变为中性,再转变为酸性且酸性不断增强;
(5)设,所用NaOH溶液的溶质质量为x,
消耗盐酸溶液中溶质的质量为:30ml×1.0g/ml×3.65%=1.095g
HCl+NaOH═NaCl+H2O;
36.5 40
1.095g x
| 36.5 |
| 1.095g |
| 40 |
| x |
x=1.2g
实验中所用NaOH溶液的溶质质量分数为:
| 12g |
| (50-30)ml×1.0g/ml |
答案:(1)红
(2)HCl+NaOH═NaCl+H2O
(3)30
(4)B
(5)6.0%
点评:本题考查酸碱混合的定性判断和计算,题目难度不大,题目结合中和反应考查了同学们观察分析问题的能力,以及利用化学方程式计算的能力,比较综合,要认真分析解答.

练习册系列答案
相关题目

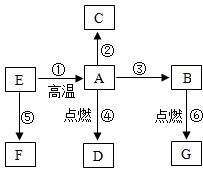 下列物质是初中化学常见的物质,A是常见的金属,②是湿法冶金的先驱,④的反应现象是火星四射,E是红棕色固体,F是黄色溶液,G是最常见的液体,这些物质之间的转化关系如图所示(部分反应物、生成物已省略):
下列物质是初中化学常见的物质,A是常见的金属,②是湿法冶金的先驱,④的反应现象是火星四射,E是红棕色固体,F是黄色溶液,G是最常见的液体,这些物质之间的转化关系如图所示(部分反应物、生成物已省略):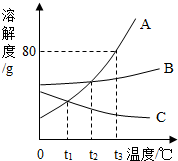 如图是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题:
如图是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题: 某人在一容器中进行了如图实验,请填空:
某人在一容器中进行了如图实验,请填空: