题目内容
12.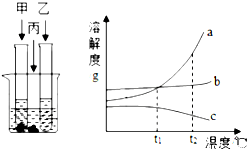 在室温情况下,甲、乙、丙三种固体分别溶于两个试管和烧杯的水中,现象如图所示,甲、丙还有剩余固体,乙固体全部溶解、升温到80℃时,发现甲固体全部溶解,乙有固体析出,丙没有明显变化.
在室温情况下,甲、乙、丙三种固体分别溶于两个试管和烧杯的水中,现象如图所示,甲、丙还有剩余固体,乙固体全部溶解、升温到80℃时,发现甲固体全部溶解,乙有固体析出,丙没有明显变化.(1)室温时,乙(选填“甲”、“乙”或“丙”)溶液可能是不饱和溶液;
(2)在t2℃时,甲、乙、丙三种物质的饱和溶液溶质质量分数由大到小的顺序是甲>丙>乙;
(3)在温度小于t1℃时,丙物质的饱和溶液一定比甲物质的饱和溶液溶质质量分数更大;
(4)下列说法中正确的是①(填序号)
①甲中含有少量乙和丙,可以采用降温结晶的方法提纯甲
②t2℃时,甲溶液溶质的质量分数比乙溶液大
③t2℃时,将等质量的甲乙丙物质分别加水溶解配制成饱和溶液,所得溶液的质量:甲>乙>丙
④将t1℃甲乙丙的饱和溶液升温到t2℃时,甲乙丙溶液溶质的质量分数都不变.
分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)据图可以看出,室温时,乙中不含有固体,故乙溶液可能是不饱和溶液,故填:乙;
(2)升温到80℃时,发现甲固体全部溶解,说明a表示的是甲,乙有固体析出,说明c表示的是乙,丙没有明显变化,说明b表示的是丙,故在t2℃时,甲、乙、丙三种物质的饱和溶液溶质质量分数由大到小的顺序是甲>丙>乙,故填:甲>丙>乙;
(3)据图可以看出,在在温度小于t1℃时,丙的溶解度大于甲,故丙物质的饱和溶液一定比甲物质的饱和溶液溶质质量分数更大,故填:小于t1℃;
(4)①甲的溶解度随温度的升高变化明显,故甲中含有少量乙和丙,可以采用降温结晶的方法提纯甲,正确;
②t2℃时,甲饱和溶液溶质的质量分数比乙饱和溶液大,错误;
③t2℃时,三种物质的溶解度关系为:甲>丙>乙,将等质量的甲乙丙物质分别加水溶解配制成饱和溶液,所得溶液的质量:乙>丙>甲,错误;
④将t1℃甲乙丙的饱和溶液升温到t2℃时,甲丙溶液溶质的质量分数都不变,乙的减小,错误.
故填:①.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.

练习册系列答案
相关题目
3.2017年2月5日,温州市天台县发生一起造成18人死亡的严重火灾事故.下列有关燃烧和消防的说法不正确的是( )
| A. | 用水灭火的原理是隔绝氧气 | |
| B. | 可燃物燃烧需要温度达到着火点 | |
| C. | 燃烧是剧烈的氧化反应 | |
| D. | 逃生过程中,用湿毛巾捂住口鼻防止热气灼伤 |
7.下列有关微粒的说法正确的是( )
| A. | 分子可分,而原子不可分 | |
| B. | 钠原子得到1个电子形成钠离子 | |
| C. | 过氧化氢分子由氢分子和氧分子组成 | |
| D. | 原子、分子、离子都是构成物质的微粒 |
17.可乐中含有磷酸,下列关于磷酸(H3PO4)的说法中,错误的是( )
| A. | H3PO4中P元素的化合价是+5价 | |
| B. | H3PO4中含2个氧分子 | |
| C. | H3PO4能使紫色石蕊溶液变成红色 | |
| D. | H3PO4中磷、氧元素的质量比为31:64 |
 甲、乙、丙为中学化学常见的物质,相互之间的关系如图所示(“-”表示两种物质能发生化学反应,“→”表示两种物质间能够通过一个反应实现转化,部分反应物或生成物以及反应条件已略去)回答下列问题
甲、乙、丙为中学化学常见的物质,相互之间的关系如图所示(“-”表示两种物质能发生化学反应,“→”表示两种物质间能够通过一个反应实现转化,部分反应物或生成物以及反应条件已略去)回答下列问题
