题目内容
2.石灰石是制造水泥、石灰、轻质碳酸钙的主要原料来源.某校科学探究小组同学把一块从实验室借来的石灰石做纯度分析,进行了如下实验:①用天平准确称取20克石灰石放入甲图A装置中,同时加入足量稀盐酸;②测量C装置中吸收到的由反应过程中产生的二氧化碳的质量,并据此绘成乙图中的曲线;③根据实验结果计算该石灰石的纯度.
请分析回答下列问题:
(1)甲图中装置B的作用是吸收水分.
(2)忽略空气中二氧化碳及盐酸挥发对实验结果的影响,你认为由C装置测得的二氧化碳质量与反应产生的二氧化碳质量相等吗?不相等,试分析原因因为装置A、B都会残留部分二氧化碳.
(3)根据实验数据计算该石灰石中CaCO3的质量分数.
分析 稀盐酸和碳酸钙反应生成二氧化碳,而通过二氧化碳来确定碳酸钙的质量,需要除去二氧化碳中的水蒸气,所以需要用浓硫酸干燥,而装置AB中都会残留部分二氧化碳,导致测量结果偏小,为使结果准确,应该从左侧向装置内加入水或者不含二氧化碳的气体把装置内的残余的二氧化碳赶出来,使之与氢氧化钠完全反应.另外本实验可以改进为关注装置A的质量变化的形式,这样装置简单,误差也小.由曲线图可以看出生成的二氧化碳的质量为6.6g,根据二氧化碳的质量和对应的化学方程式求算碳酸钙的质量,进而求算对应的质量分数.
解答 解:稀盐酸和碳酸钙反应生成二氧化碳,而通过二氧化碳来确定碳酸钙的质量,需要除去二氧化碳中的水蒸气,所以需要用浓硫酸干燥,而装置AB中都会残留部分二氧化碳,导致测量结果偏小,为使结果准确,应该从左侧向装置内加入水或者不含二氧化碳的气体把装置内的残余的二氧化碳赶出来,使之与氢氧化钠完全反应.
(1)甲图中装置B的作用是 吸收水分.
(2)忽略空气中二氧化碳及盐酸挥发对实验结果的影响,你认为由C装置测得的二氧化碳质量与反应产生的二氧化碳质量相等吗?不相等,试分析原因 因为装置A、B都会残留部分二氧化碳.
(3)设碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 6.6g
$\frac{100}{44}$=$\frac{x}{6.6g}$
x=15g
该石灰石中CaCO3的质量分数为$\frac{15g}{20g}$×100%=75%.
故答案为:(1)吸收水分.
(2)不相等; 因为装置A、B都会残留部分二氧化碳.
(3)75%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

 硝酸钾在不同温度下的溶解度如下表:
硝酸钾在不同温度下的溶解度如下表:| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 |
| 溶解度(克) | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.8 |
(2)步骤(1)所得溶液饱和吗?若不饱和,至少需要加入多少克硝酸钾才能饱和?
(3)将步骤(1)所得的溶液盛放在如图所示的小烧杯中,若将少量的下列物质分别放到大烧杯的水中,不断搅拌,则小烧杯中一定有硝酸钾晶体析出的是BD填字母).
A、水 B、冰 C、氢氧化钠 D、硝酸铵.
| 序号 | ① | ② | ③ | ④ |
| 物质 | 醋酸 | 烧碱 | 熟石灰 | 纯碱 |
| 化学式 | CH3COOH | NaOH | Ca(OH)2 | Na2CO3 |
(2)我国化工专家侯德榜发明的“联合制碱法”在生产④方面作出了重大的贡献.
| A. | 苛性钠 NaOH | B. | 纯碱Na2CO3 | C. | 熟石灰CaO | D. | 胆矾CuSO4•5H2O |
| A. | N2 | B. | CO2 | C. | O2 | D. | CO |

| A. | 实验1烧杯壁发烫 | B. | 实验2有气泡产生 | ||
| C. | 实验3红色逐渐变浅 | D. | 实验4形成蓝色溶液 |
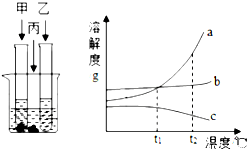 在室温情况下,甲、乙、丙三种固体分别溶于两个试管和烧杯的水中,现象如图所示,甲、丙还有剩余固体,乙固体全部溶解、升温到80℃时,发现甲固体全部溶解,乙有固体析出,丙没有明显变化.
在室温情况下,甲、乙、丙三种固体分别溶于两个试管和烧杯的水中,现象如图所示,甲、丙还有剩余固体,乙固体全部溶解、升温到80℃时,发现甲固体全部溶解,乙有固体析出,丙没有明显变化.