题目内容
6. “钢铁”是钢(含碳0.03%-2%)和生铁(含碳2%-4.3%)的统称.某小组同学称取一块质量为5.8g的“钢铁”对其组成进行探究(假设“钢铁”中没有别的杂质).
“钢铁”是钢(含碳0.03%-2%)和生铁(含碳2%-4.3%)的统称.某小组同学称取一块质量为5.8g的“钢铁”对其组成进行探究(假设“钢铁”中没有别的杂质).(1)钢铁属于合金(填“纯金属”或“合金”).
(2)将“钢铁”仔细粉碎后,逐滴加入稀盐酸,产生气体的质量与所加盐酸的质量关系如图所示.列式计算并判断这块“钢铁”是钢还是生铁?
(3)上述实验中,能(填“能”或“不能”)用稀硫酸代替盐酸:若能,写出反应的化学方程式,若不能,请说明原因:Fe+H2SO4=FeSO4+H2↑.
分析 (1)根据钢铁和生铁都是碳和铁组成的合金进行分析;
(2)根据生成的氢气质量,依据化学方程式计算参加反应的铁的质量,进而计算出碳的质量分数;
(3)根据铁和硫酸反应生成硫酸亚铁和氢气进行分析.
解答 解:(1)钢铁和生铁都是碳和铁组成的合金;
(2)设钢铁中含铁的质量为x
Fe+2HCl=FeCl2+H2↑
56 2
x 0.2g
$\frac{56}{x}$=$\frac{2}{0.2g}$
x=5.6g
所以钢铁中的含碳量为:$\frac{5.8g-5.6g}{5.8g}$×100%=3.45%,所以该合金是生铁;
(3)铁和硫酸反应生成硫酸亚铁和氢气,所以能用稀硫酸代替稀盐酸,化学方程式为:Fe+H2SO4=FeSO4+H2↑.
故答案为:(1)合金;
(2)生铁;
(3)能,Fe+H2SO4=FeSO4+H2↑.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
17.由燃烧的条件判断下列说法正确的是( )
| A. | 燃烧一定会引起爆炸 | |
| B. | 用玻璃杯罩住点燃的蜡烛,火焰熄灭是因为隔绝了空气 | |
| C. | 只要外界条件足够,所有物质都能燃烧 | |
| D. | 水能灭火主要是因为水蒸发吸热,降低了可燃物的着火点 |
14.饮料中的果味大多来自酯类.丁酸酯[C6H12O2]是无色具有菠萝味的液体,常用作食品、饮料的调香剂.下列叙述中,正确的是( )
| A. | 丁酸乙酯由20个原子构成 | |
| B. | 丁酸乙酯的相对分子质量为116g | |
| C. | 丁酸乙酯中碳、氢、氧元素的质量比为18:3:8 | |
| D. | 丁酸乙酯分子中含有碳原子,氢原子和氧分子 |
11.根据如图信息,下列理解错误的是( )
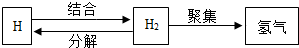

| A. | 原子可结合成分子 | |
| B. | 氢分子的形成过程可表示为: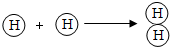 | |
| C. | 物质都是由分子构成 | |
| D. | 化学变化的实质是分子的分裂和原子的重新组合 |
15.下列各组物质,按单质、化合物、混合物顺序排列的是( )
| A. | 氢气、烧碱、冰水共存物 | B. | 天然气、煤、石油 | ||
| C. | 液态氧、二氧化硫、稀硫酸 | D. | 稀有气体、酒精、石灰石 |
 奥运会火炬采用中国传统祥云图案和纸卷轴为创意设计,其外壳由铝合金材料制成,使用的燃料是丙烷(C3 H8).1)铝的化学性质很活泼,与空气中的氧气反应,能在其表面生成一层致密的氧化铝(A1203)薄膜,因而铝又具有很好的抗腐蚀性能.
奥运会火炬采用中国传统祥云图案和纸卷轴为创意设计,其外壳由铝合金材料制成,使用的燃料是丙烷(C3 H8).1)铝的化学性质很活泼,与空气中的氧气反应,能在其表面生成一层致密的氧化铝(A1203)薄膜,因而铝又具有很好的抗腐蚀性能.
