题目内容
12.某样品为铁粉和铜粉的混合物,为了测定样品中含铜的质量分数,甲、乙、丙、丁四同学用同一样品分别进行实验.测得数据如下:| 甲 | 乙 | 丙 | 丁 | |
| 所取固体样品的质量(g) | 20 | 15 | 10 | 10 |
| 加入硫酸溶液的质量(g) | 100 | 100 | 100 | 120 |
| 反应后剩余固体质量(g) | 14.4 | 9.4 | 4.4 | 4.4 |
(1)样品中铜的质量分数是多少?
(2)乙同学反应后的溶液质量是多少?
分析 (1)根据铁和硫酸反应生成硫酸亚铁和氢气,而铜不和硫酸,进而求出样品中铜的质量分数进行解答;
(2)根据实验数据可知,甲、乙、丙、丁,消可知耗铁的质量都是5.6g,所以由乙可知,100g硫酸全部反应,由丁可知,10g样品中的铁全部反应,故当所取固体和稀硫酸的质量比为10g:100g时,表示混合物中的铁粉与稀硫酸中的硫酸恰好完全反应进行解答.
解答 解:(1)根据实验数据可知,甲、乙、丙、丁,消可知耗铁的质量都是5.6g,所以由乙可知,100g硫酸全部反应,由丁可知,10g样品中的铁全部反应,故当所取固体和稀硫酸的质量比为10g:100g时,表示混合物中的铁粉与稀硫酸中的硫酸恰好完全反应,所以丙实验中铁粉与稀硫酸中的硫酸恰好完全反应.样品中铜的质量分数=$\frac{4.4g}{10g}$×110%=44%;
(2)设生成氢气的质量为x
H2SO4+Fe=FeSO4+H2↑
56 2
5.6g x
$\frac{56}{5.6g}$=$\frac{2}{x}$
x=0.2g
乙同学反应后的溶液质量是100g+5.6g-0.2g=105.4g
故答案为:(1)44%;(2)105.4g.
点评 本题主要考查学生利用化学方程式进行计算的能力,关键有两点一是必须把化学方程式配平,二是步骤必须规范.

练习册系列答案
相关题目
20. 在测定空气中氧气含量的实验中,小强采用了如图所示装置:在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热.同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热.待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化.
在测定空气中氧气含量的实验中,小强采用了如图所示装置:在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热.同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热.待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化.
(1)在实验加热过程中,交替缓慢推动两个注射器活塞的目的是使空气中的氧气充分反应.
(2)写出该实验中反应的化学方程式2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO.
(3)小强测得实验结果如下:
由此数据可以推算出他测定的空气中氧气的体积分数<21%(填“>”、“=”或“<”).造成该实验出现误差的原因可能是①②③.(填序号)
①没有交替缓缓推动两个注射器活塞 ②读数时没有冷却至室温 ③加入铜丝量太少 ④加入铜丝量太多.
(4)通过上面的实验,你学到的测量混合物中某成分含量的方法是通过化学反应除去混合物中的一种成分,再测量混合物在反应前后体积(或质量)的变化,从而得出该种成分的含量.(其它答案合理也可).
 在测定空气中氧气含量的实验中,小强采用了如图所示装置:在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热.同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热.待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化.
在测定空气中氧气含量的实验中,小强采用了如图所示装置:在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热.同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热.待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化.(1)在实验加热过程中,交替缓慢推动两个注射器活塞的目的是使空气中的氧气充分反应.
(2)写出该实验中反应的化学方程式2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO.
(3)小强测得实验结果如下:
| 反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
| 25mL | 22mL |
①没有交替缓缓推动两个注射器活塞 ②读数时没有冷却至室温 ③加入铜丝量太少 ④加入铜丝量太多.
(4)通过上面的实验,你学到的测量混合物中某成分含量的方法是通过化学反应除去混合物中的一种成分,再测量混合物在反应前后体积(或质量)的变化,从而得出该种成分的含量.(其它答案合理也可).
7.下列关于铁的叙述不正确的是( )
| A. | 纯铁为银白色金属 | B. | 纯铁有良好的延展性 | ||
| C. | 铁丝在氧气中可以燃烧 | D. | 铁跟稀硫酸反应生成硫酸铁 |
1.下列物质中,属于有机物的是( )
| A. | 二氧化碳 | B. | 一氧化碳 | C. | 碳酸氢钠 | D. | 尿素 |
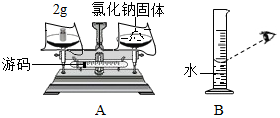 实验室欲配制50克溶质质量分数为5%的氯化钠溶液,试回答下列问题:
实验室欲配制50克溶质质量分数为5%的氯化钠溶液,试回答下列问题: