题目内容
实验室有瓶标签模糊的烧碱溶液,小军测量其溶质质量分数的操作如下:
①取一洁净的锥形瓶称量,其质量为25.5g,往其中注入一定量上述烧碱溶液,并滴入1滴酚酞溶液后,又称量锥形瓶,质量为37.5g;
②取质量分数为24.5%的稀硫酸逐滴滴入上述锥形瓶中,边滴边振荡,当观察到溶液由红色变为无色时,停止滴液。再次称量锥形瓶,质 量为51.0g
量为51.0g
请解答下列问题:
(1)所取烧碱溶液的质量 = g。(注:滴人酚酞的质量忽略不计)
(2)反应所消耗的稀硫酸质量= g。
(3)通过计算确定该瓶烧碱溶液的溶质质量分数。(列出计算过程)
(4)问题讨论:小亮做同样的实验得到的结果与小军的结果有差异。于是小亮测自己实验后锥形瓶内溶液的pH,pH =6.2,则小亮的结果比小军的 (选填“偏大 ”或“偏小”或“无影响”),原因是 。
”或“偏小”或“无影响”),原因是 。
【答案】(1)12g(2) 13.5g (3)22.5% (4)偏大;滴加的稀硫酸过量
【解析】(1)所取烧碱溶液的质量=37.5g-25.5g=12g;
(2)反应所消耗的稀硫酸质量=51.0g-37.5g=13.5g;
(3)设该瓶烧碱溶液的溶质质量为x。
2NaOH+ H2SO4= Na 2SO4 + 2H2O
80 98
X 13.5g×24.5%
80:98= x:(13.5g×24.5%)
x=2.7g
该瓶烧碱溶液的溶质质量分数=2.7g/12g×100﹪=22.5﹪
答:该瓶烧碱溶液的溶质质量分数为22.5﹪。
(4)反应后溶液显酸性,则加入的硫酸过量,如果根据硫酸的质量计算氢氧化钠的质量时,则氢氧化钠的质量偏大,所以计算确定的烧碱溶液的溶质质量分数偏大。


 D.甲烷(CH4)
D.甲烷(CH4)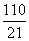
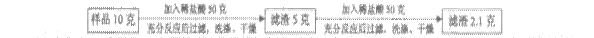
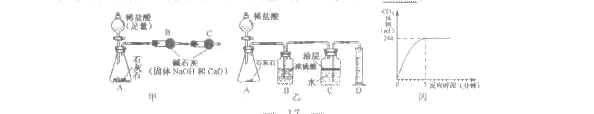
 CuSO4+ xH2O↑
CuSO4+ xH2O↑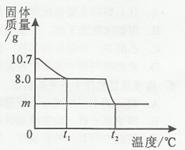

 mg;
mg;