题目内容
8. 实验室用溶质质量分数为10%氢氧化钠溶液进行水的电解实验.
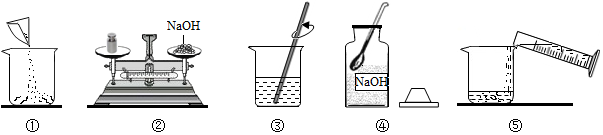
实验室用溶质质量分数为10%氢氧化钠溶液进行水的电解实验.【实验一】配制溶质质量分数为10%氢氧化钠溶液100g.
(1)所需的氢氧化钠质量10g;需要水的质量90g,体积为90mL(水的密度为1g/cm3).量水时若仰视读数,则配得溶液的溶质质量分数将偏小(“偏大”或“偏小”).
(2)称量时,氢氧化钠固体应放于天平左(填“左”或“右”)盘的烧杯内;量取所需要的水(水的密度为1g/cm3),应选择的量筒的规格是100mL(选填“10”、“100”或“250”).
【实验二】水的电解实验
用如图装置进行水的电解实验.已知氢氧化钠在水的电解实验中,只起到增强水的导电性作用.
(3)开始反应前a,b两管内都充满溶液.关闭活塞,接通电源,一段时间后,两管产生的气体如图所示,则a管中的气体是氢气,可以用燃着的木条来检验.b管中的气体用带火星的木条验证,现象为带火星的木条复燃.写出电解水的化学方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
(4)电解后溶液的溶质质量分数>10%(填“<”、“=”或“>”).
分析 (1)溶质质量=溶液质量×溶质质量分数;
(2)称量物质质量时,应该是左物右砝;
选择量筒时,量程应该大于或等于量取液体的体积;
(3)电解水时,正极产生的是氧气,负极产生的是氢气,氧气和氢气的体积比约为1:2,氢气燃烧产生淡蓝色火焰,氧气能使带火星的木条复燃;
(4)电解后氢氧化钠质量不变,溶液质量减小,因此溶液的溶质质量分数变大.
解答 解:(1)所需的氢氧化钠质量为:100g×10%=10g,需要水的质量为:100g-10g=90g,水的体积为:90g÷1g/mL=90mL;
量水时若仰视读数,导致量取水的体积偏大,则配得溶液的溶质质量分数将偏小.
故填:10;90g;90;偏小.
(2)称量时,氢氧化钠固体应放于天平左盘的烧杯内;量取所需要的水的体积是90mL,应选择的量筒的规格是100mL.
故填:左;100.
(3)开始反应前a,b两管内都充满溶液.关闭活塞,接通电源,一段时间后,两管产生的气体如图所示,则a管中的气体是氢气,可以用来燃着的木条检验;
b管中的气体是氧气,可以用带火星的木条验证,现象为带火星的木条复燃;
电解水的化学方程式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
故填:氢气;燃着的木条;带火星的木条;带火星的木条复燃;2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
(4)电解后氢氧化钠质量不变,溶液质量减小,因此溶液的溶质质量分数变大.
故填:>.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
20.卢瑟福提出原子核式结构学说的根据是在用α粒子轰击金箔的实验中,发现粒子( )
| A. | 全部穿过或发生很小的偏转 | |
| B. | 全部发生很大的偏转 | |
| C. | 绝大多数穿过,只有少数发生很大偏转,甚至极少数被弹回 | |
| D. | 绝大多数发生偏转,甚至被弹回 |
18.为了保持鲜花的盛开,花工们对大量盆栽鲜花使用了S-诱抗素制剂.S-诱抗素的化学式为C15H20O4.下列关于S-诱抗素的叙述中不正确的是( )
| A. | S-诱抗素由三种元素组成 | |
| B. | S-诱抗素属于有机化合物 | |
| C. | S-诱抗素中氢元素的质量分数最大 | |
| D. | S-诱抗素中碳、氢、氧三种元素的质量比为45:5:16 |
 很多同学都喜欢既别致又实用的叶脉书签,其制作方法如下:首先选取大小适当、稍老一些的树叶(如桂树叶)放在烧杯中,加入100g 12%的氢氧化钠溶液,加热煮沸10~15min(不搅拌),取出,冲洗,将叶片压平,最后系上各色丝带,漂亮的叶脉书签便做好了.
很多同学都喜欢既别致又实用的叶脉书签,其制作方法如下:首先选取大小适当、稍老一些的树叶(如桂树叶)放在烧杯中,加入100g 12%的氢氧化钠溶液,加热煮沸10~15min(不搅拌),取出,冲洗,将叶片压平,最后系上各色丝带,漂亮的叶脉书签便做好了.