题目内容
4. 甲、乙、丙三位同学对氯化镁样品(仅含氯化铝杂质)进行如下检测:取457g样品溶于一定量的水中得到8000g溶液,再逐渐加入固体氢氧化钠,反应得到沉淀和加入的氢氧化钠的质量图象如图:(已知氢氧化铝沉淀可以和氢氧化钠溶液反应生成无色溶液,反应方程式为Al(OH)3+NaOH═NaAlO2+2H2O)
甲、乙、丙三位同学对氯化镁样品(仅含氯化铝杂质)进行如下检测:取457g样品溶于一定量的水中得到8000g溶液,再逐渐加入固体氢氧化钠,反应得到沉淀和加入的氢氧化钠的质量图象如图:(已知氢氧化铝沉淀可以和氢氧化钠溶液反应生成无色溶液,反应方程式为Al(OH)3+NaOH═NaAlO2+2H2O)X轴表示加入氢氧化钠的质量,Y轴表示生成沉淀的质量.W为116克,K为272克,试回答下列问题:
(1)如图图象中,A点氢氧化钠的质量为400g,B点氢氧化钠的质量与A点氢氧化钠的质量的差值为80g.
(2)计算氯化镁样品的质量分数(保留到0.01),写出过程.
分析 由图中可知,W为反应生成氢氧化镁的质量,K和W的差即为反应生成氢氧化铝的质量,W为生成氢氧化镁的质量,氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠,氯化铝和氢氧化钠反应生成氢氧化铝沉淀和氯化钠,根据反应的化学方程式和提供的数据可以进行相关方面的计算和判断.
解答 解:(1)设氯化镁质量为x,和氯化镁反应的氢氧化钠质量为y,和氯化铝反应的氢氧化钠质量为z,
反应生成氢氧化铝质量为:272g-116g=156g,
MgCl2+2NaOH═Mg(OH)2↓+2NaCl,AlCl3+3NaOH═Al(OH)3↓+3NaCl,
95 80 58 120 78
x y 116g z 156g
$\frac{95}{x}$=$\frac{80}{y}$=$\frac{58}{116g}$,$\frac{120}{z}$=$\frac{78}{156g}$,
x=190g,y=160g,z=240g,
如图图象中,A点氢氧化钠的质量为:160g+240g=400g;
设溶解156g氢氧化铝需要氢氧化钠的质量为m,
Al(OH)3+NaOH═NaAlO2+2H2O,
78 40
156g m
$\frac{78}{156g}$=$\frac{40}{m}$,
m=80g,
因此B点氢氧化钠的质量与A点氢氧化钠的质量的差值为80g.
故填:400;80.
(2)样品中氯化镁的质量分数为:$\frac{190g}{457g}$×100%=41.58%,
答:样品中氯化镁的质量分数为41.58%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

| A. | 石灰水 二氧化锰 | B. | 水 高锰酸钾 | C. | 氯化钠 空气 | D. | 矿泉水,硫粉 |
| A. |  氧气验满 | B. |  取用药品 | C. |  称取氯化钠 称取氯化钠 | D. |  稀释浓硫酸 |
| 发生装置 | 收集装置 | 洗气装置 |
 |  |  |
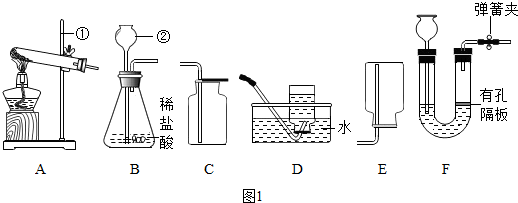
(2)实验室用过氧化氢和二氧化锰制取氧气的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,气体发生装置为B(填字母).
(3)实验室用石灰石和稀盐酸制取CO2的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,该反应生成的CO2中常混有少量氯化氢气体,可用盛有饱和NaHCO3溶液的F装置将其除去,混合气体应从F装置的②口(填“①”或“②”)通入.
| A. | 元素的化学性质取决于核外电子数 | |
| B. | 分子能保持物质的化学性质,原子不能 | |
| C. | 氯化钠是由钠原子和氯原子构成的 | |
| D. | 分子和原子的主要区别是在化学变化中分子可分,而原子不可分 |