题目内容
2. 2012年1月15日,广西龙江河发生镉污染事件,如图是镉元素在元素周期表中的信息,从该图获取的信息中,正确的是( )
2012年1月15日,广西龙江河发生镉污染事件,如图是镉元素在元素周期表中的信息,从该图获取的信息中,正确的是( )| A. | 镉原子的核外有48个电子 | B. | 镉元素的原子序数为112 | ||
| C. | 镉元素属于非金属元素 | D. | 镉元素相对原子质量为112.4g |
分析 根据图中元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量,进行分析判断即可.
解答 解:A、根据元素周期表中的一格可知,左上角的数字为48,表示原子序数为48;根据原子序数=核电荷数=质子数=核外电子数,则该元素的原子核外电子数为48,故选项说法正确.
B、根据元素周期表中的一格可知,左上角的数字为48,该元素的原子序数为48,故选项说法错误.
C、根据元素周期表中的一格可知,中间的汉字表示元素名称,该元素的名称是镉,属于金属元素,故选项说法错误.
D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为112.4,相对原子质量单位是“1”,不是“克”,故选项说法错误.
故选:A.
点评 本题难度不大,考查学生灵活运用元素周期表中元素的信息(原子序数、元素符号、元素名称、相对原子质量)进行分析解题的能力.

练习册系列答案
相关题目
3.下列实验方案不合理的是( )
| A. | 区分热固性塑料和热塑性塑料--加热,观察外形变化 | |
| B. | 区别硝酸钾和硝酸铵--用熟石灰 | |
| C. | 鉴别NaOH、K2CO3、BaCl2三种白色固体--用稀H2SO4 | |
| D. | 检验CaO中是否含有Ca(OH)2--加水后滴加酚酞溶液 |
14.化学兴趣小组的同学分成甲、乙两组对溶液的鉴别进行探究,请你分析并填空.
【实验目的】Na2CO3溶液、NaOH溶液、Ca(OH)2溶液、稀盐酸四种溶液的鉴别.
【实验药品】未贴标签的四瓶溶液[Na2CO3溶液、NaOH溶液、Ca(OH)2溶液、稀盐酸]和紫色石蕊试剂.
【实验仪器】试管、胶头滴管等.
【设计并实验】甲组同学利用紫色石蕊试剂鉴别四种溶液:
乙组同学经讨论认为,不用紫色石蕊试剂也能鉴别出四种溶液.各自分别做了如下实验:
乙组三位同学经过交流后发现本组小勇同学的结论是错误的,所滴加的溶液应是Ca(OH)2溶液,由此鉴别出了四种溶液.
【反应与体会】
①物质的鉴别有多种方法;
②鉴别物质的关键是利用物质的特征性质等.
【实验目的】Na2CO3溶液、NaOH溶液、Ca(OH)2溶液、稀盐酸四种溶液的鉴别.
【实验药品】未贴标签的四瓶溶液[Na2CO3溶液、NaOH溶液、Ca(OH)2溶液、稀盐酸]和紫色石蕊试剂.
【实验仪器】试管、胶头滴管等.
【设计并实验】甲组同学利用紫色石蕊试剂鉴别四种溶液:
| 实验操作和步骤 | 实验现象与结论 |
| (1)用4支试管,各取少量四种溶液,分别滴加紫色石蕊试剂; | 一支试管中溶液变为红色,则原溶液是稀盐酸. |
| (2)另用3支试管,各取少量未确定的三种溶液,分别滴加步骤(1)检验出的溶液. | 一支试管中溶液有气泡放出,则原溶液是Na2CO3溶液 |
| (3)另用2支试管,各取少量未确定的二种溶液,分别滴加步骤(2)检验出的溶液 | 一支试管溶液中有白色沉淀析出,则原溶液是Ca(OH)2溶液,其反应的化学方程式 为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;剩下的就是最后一种溶液. |
| 同学 | 实验操作 | 实现现象 | 结论 |
| 小红 | 用3支试管,各取少量三种溶液,分别滴加另一种溶液. | 一支试管溶液中有气泡放出,其余两支试管溶液中无现象. | 所滴加的溶液是稀盐酸. |
| 小勇 | 一支试管溶液中有白色沉淀析出,其余两支试管溶液中无现象. | 所滴加的溶液是Na2CO3溶液. | |
| 小新 | 三支试管溶液中都无现象. | 所滴加的溶液是NaOH溶液 |
【反应与体会】
①物质的鉴别有多种方法;
②鉴别物质的关键是利用物质的特征性质等.
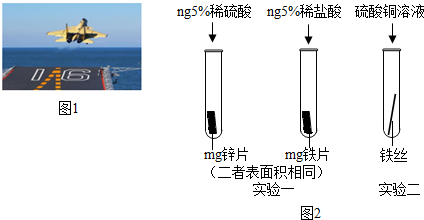
11.金属材料在国防建设中起着重要的作用,如图1为歼-15飞机在辽宁舰上起飞.
(1)铝合金用于制造飞机的外壳,铝合金材质的主要优点是硬度大、密度小.
(2)改装前的辽宁舰舰身锈迹斑斑,钢铁的锈蚀主要是铁与空气中的氧气与水蒸气共同作用的结果.铁锈的成分主要是Fe2O3(填化学式).
(3)为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强金属.小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图2的两个实验:
①实验一中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是所用酸的种类不同
②实验二中,若出现铁丝表面附着红色固体现象,可证明铁的活动性强于铜,该反应的化学方程式为Fe+CuSO4═FeSO4+Cu
(4)辽宁舰的建造耗费了大量的钢材.某兴趣小组在实验室用图3所示装置模拟炼铁的化学原理,并测定赤铁矿中氧化铁的质量分数(装置气密性良好,CO2被充分吸收,氧化铁反应完全且赤铁矿中的杂质不参加反应,称重赤铁矿样品的质量为Wg).
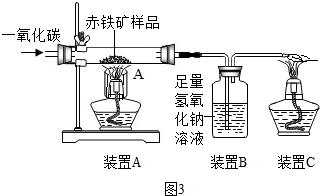
①装置A中生成铁的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,装置C的作用是将CO燃烧防止其污染空气
②要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是装置A在反应前后的质量变化或装置B在反应前后的质量变化.
③设计实验证明锌、铁、铜三种金属的金属活动性强弱,要求写出实验步骤、现象和结论.

(1)铝合金用于制造飞机的外壳,铝合金材质的主要优点是硬度大、密度小.
(2)改装前的辽宁舰舰身锈迹斑斑,钢铁的锈蚀主要是铁与空气中的氧气与水蒸气共同作用的结果.铁锈的成分主要是Fe2O3(填化学式).
(3)为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强金属.小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图2的两个实验:
①实验一中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是所用酸的种类不同
②实验二中,若出现铁丝表面附着红色固体现象,可证明铁的活动性强于铜,该反应的化学方程式为Fe+CuSO4═FeSO4+Cu
(4)辽宁舰的建造耗费了大量的钢材.某兴趣小组在实验室用图3所示装置模拟炼铁的化学原理,并测定赤铁矿中氧化铁的质量分数(装置气密性良好,CO2被充分吸收,氧化铁反应完全且赤铁矿中的杂质不参加反应,称重赤铁矿样品的质量为Wg).

①装置A中生成铁的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,装置C的作用是将CO燃烧防止其污染空气
②要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是装置A在反应前后的质量变化或装置B在反应前后的质量变化.
③设计实验证明锌、铁、铜三种金属的金属活动性强弱,要求写出实验步骤、现象和结论.
| 实验步骤 | 实验现象 | 实验结论 |
| 分别取少量硫酸铜溶液、硫酸锌溶液于两支试管中,将铁丝分别浸入两溶液中,观察现象 | 浸入硫酸铜溶液中的铁丝表面出现红色固体,溶液由蓝色逐渐变为浅绿色;浸入硫酸锌溶液的铁丝无明显变化 | 金属活动性顺序: Zn>Fe>Cu |