题目内容
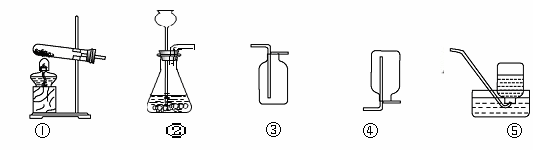
为探究气体X的组成,某兴趣小组进行图所示实验(固定装置未画出)。
【资料在线】
(1)加热条件下,气体X能与氧化铜反应生成铜、水和氮气。
(2)碱 石灰为固体氢氧化钠和氧
石灰为固体氢氧化钠和氧 化钙的混合物,不与气体X反应。无水氯化钙可吸收气体X。
化钙的混合物,不与气体X反应。无水氯化钙可吸收气体X。
(3)本实验条件下,氮气密度为1.15g·L-1,装置内空气中的水与二氧化碳对相关数据测定的影响可忽略不计。
【实验步骤】
(1)连接仪器,并检查装置气密性。
(2)取一定量氧化铜,准确称得其质量为2.40g。
(3)按图所示装入药品,测量并记录相关数据Ⅰ(见表)。
(4)连接A、B、C装置, 将气体X缓缓通入一段时间后,连接上D装置,读数后开始加热。当A装置中氧化铜反应完全,停止加热,继续通入气体X至玻璃管冷却,再次测量并记录相关数据Ⅱ(见表)。
【实验装置】

【相关数据】
| 测量项目 数据编号 | I | II |
| 玻璃管(含药品)的质量/g | 52.40 | 51.92 |
| B装置(含药品)的质量/g | 102.00 | 102.54 |
| 氮气的体积/mL | 243.5 |
【回答问题】
⑴B装置中氧化钙吸水的原理为 (用化学方程式表示)。
⑵实验过程中,当观察到 ,说明氧化铜已反应完全,停止加热,继续通入气体X至玻璃管冷却的目的是 。
⑶分析 实验测量的数据,生成水的质量为 g,氧化铜中氧元素的质量为 g。由此推知,气体X中一定 (填“有”或 “没有”)氧元素。
实验测量的数据,生成水的质量为 g,氧化铜中氧元素的质量为 g。由此推知,气体X中一定 (填“有”或 “没有”)氧元素。
⑷通过计算推导出气体X的化学式。
【答案】(1)CaO+H2O=Ca(OH)2
(2)量气管内液面不再下降 防止灼热的铜被氧化
(3)0.54 0.48 没有
(4)解:设气体X的化学式为NmHn。
氮元素的质量/氢元素的质量=14m/n=(1.15g·L-1×0.2435L)/(0.54g-0.48g)
m/n=1/3
答:气体X的化学式为NH3。
【解析】(1)氧化钙吸水的原理为CaO+H2O=Ca(OH)2;⑵加热条件下,气体X能与氧化铜反应生成氮气,氧化铜反应完全后不再产生氮气,量气管中的液面就不会再下降;高温下的铜容易和氧气发生氧化反应产生氧化铜,所以要继续通入气体X至玻璃管冷;⑶B装置增加的质量即为产生水的质量,A装置减少的质量即为氧化铜中氧元素的质量,通过计算可知水中氧元素的质量与氧化铜中氧元素的质量相等,根据反应前后元素的质量不变可得出气体X中不含有氧元素;(4)根据反应前后元素的质量不变,反应后生成氮气的质量和水中氢元素的质量与气体X中氮元素和氢元素的质量相等,然后依据化合物元素的质量之比等于元素的相对原子质量乘以个数之比,列式即可解答。

 名校课堂系列答案
名校课堂系列答案某同学用氢氧化钙和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液中滴加稀盐酸一会儿后,发现忘记了滴加指示剂,因此,他停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行了如下探究。请你和他一起完成探究活动。
【提出问题】溶液中的溶质是什么物质?
【作出猜想】猜想一:溶液质只有氯化钙。
猜想二:溶质中有CaCl2和Ca(OH)2。
猜想三:溶液中有
【查阅资料】氯化钙溶液呈中性。
【方案设计】
| 方案 | 方法步骤 | 实验现象 | 实验结论 |
| 方案一 | 取少量烧杯内的溶液于试管中,滴入几滴无色酚酞溶液 | 酚酞不变色 | 猜想一正确 |
| 酚酞变红色 | 猜想二正确 | ||
| 方案二 | 取少量烧杯内的溶液于试管中,逐滴加入 溶液至过量 |
| 猜想三正确 |
【方案评价】该同学与同学们通过讨论后认为:(1)方案一能证明猜想二正确,但不能证明猜想一正确。(2)方案二可行,但该同学在记录时未记录完整,请你替他将方案二补充完整。
【方案反思】方案一不能证明猜想一正确的理由是 。
【拓展与应用】实验证明猜想三是正确的。要想使溶液中的溶质只有氯化钙,你认为应该进行的实验步骤是 。
【结论】在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑 。
有一种神奇的蜡烛,点燃后任你怎么吹也吹不灭,而且看上去和普通的蜡烛一样,那么到底是什么玄机能让蜡烛持续燃烧?请你一起参与探究。
查阅资料:普通蜡烛由石蜡和蜡烛芯制成,而吹不灭的蜡烛是在蜡烛芯上包裹一层打火石的粉末。打火石是由某种金属掺入少量稀土元素制成的合金,它的着火点只有150℃.当蜡烛燃烧时,金属并不燃烧;但当蜡烛吹灭后,未冷却的金属接触氧气就发生燃烧,从而使蜡烛复燃。
老师告诉同学们,蜡烛芯内打火石中的某种金属可能是镁、铁或铜中的一种,为确定该金属的成分,大家设计了以下实验方案,请你填空和回答有关问题(注:不考虑打火石中稀土元素对探究金属性质的影响)
| 实验 | 操作步骤 | 实验现象 | 实验结论 |
| 1 | 切开蜡烛,取出打火石,用砂纸打磨 | 打火石呈银白色 | 该金属一定不是铜。 |
| 2 | 取少量打磨后的打火石于试管中,滴加稀盐酸 | 有无色气体产生,溶液为无色。 | 该金属一定不是铁,而是镁。 |
反思交流:
(1)实验2中反应的化学方程式为 。
(2)这种蜡烛燃烧时,蜡烛芯里的金属为什么不燃烧? 。
(3)这种“吹不灭”的蜡烛实际上也可以熄灭,你采用的方法是 。
某同学家中有一袋化肥,可能混入了其它化肥,且化肥包装袋上字迹模糊。该同学进行了以下探究,请你参与探究并填空:
【提出问题】该化肥中含有什么物质?
【收集信息】经询问得知,该化肥可能为铵态氮肥。
【提出猜想】该化肥所含的阴离子可能是Cl-、CO32-、SO42-中的一种或几种。
【实验、记录与分析】
【实验、记录与分析】
| 实验操作步骤 | 实验现象 | 实验分析 |
| (1)取少量该化肥样品和少量熟石灰放在研钵中混合研磨,观察现象 | ① | 含有铵根离子 |
| (2)另取少量该化肥样品于试管中,加入适量的水完全溶解,滴加足量的硝酸钡溶液,再滴加少量稀硝酸,观察 | 无沉淀 | 没有 ② 存在 |
| (3)取(2)所得滤液少量于试管中,滴加 硝酸银溶液,观察 | ③ | 有Cl-存在 |
【实验结论】若该化肥中只含有一种阳离子,则其中一定含有的物质是(写化学式):④ 。
写出步骤③的化学方程式 ⑤ 。


 (4)D图的装置可用来制取的气体是 (写—种),制取该气体的化学方程式为:
(4)D图的装置可用来制取的气体是 (写—种),制取该气体的化学方程式为:
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑