题目内容
4.2003年12月23日,川东气矿发生井喷事故,高压天然气携带一种无色有臭鸡蛋气味的气体--硫化氢(H2S)从地下喷出,向四周扩散,造成了上百人死亡.抢险队和救援队迅速进入事故地点并点燃了喷出的气体,切断有毒气体来源,并不断向空中喷洒碱水;救援队员发现,低洼地的人、蓄死亡率高,但是有一老年幸存者因摔到在水田里,头埋在和着烂泥的潮湿的草里,而幸免于中毒.若请你根据上面的叙述,回答下列问题:
(1)硫化氢具有的物理性质:无色有臭鸡蛋气味的气体,能溶或易溶于水,密度比空气大.
(2)硫化氢具有的化学性质:有毒,能与碱溶液反应.
(3)如果你当时出在事故现场,你准备怎样保护自己?湿毛巾堵住口鼻,向高处跑.
(4)当地政府已经通知下游群众不要饮用河沟水,因为硫化氢能溶于水,有毒.
(5)实验室常用硫化亚铁固体与稀硫酸常温接触制取硫化氢气体,如图1的实验装置中能用于制取硫化氢气体的发生装置是(填编号)B,收集装置是D.此装置还可用来制取气体(答一种)氧气,其对应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.

(6)实验室用氯酸钾或高锰酸钾制取氧气时,应选用(填编号)A,选择该装置的理由是反应物状态是固体,反应条件是加热,对应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.若要收集到较纯净的氧气应选用(填图1中编号)E装置.
(7)小明同学探究B装置时,对此装置作了改进,改进的装置如图2所示.改进后该装置的优点是可控制反应随时发生和停止.
(8)实验室在常温下用块状电石与水反应制取微溶于水的乙炔气体,该反应必须严格控制加水速度,以免剧烈反应放热引起发生装置炸裂.
你认为B装置应如何改进才符合要求将长颈漏斗改为分液漏斗.
分析 物理性质是指物质不需要发生化学变化就表现出来的性质.化学性质是指物质在化学变化中表现出来的性质.而化学变化的本质特征是变化中有新物质生成,因此,判断物理性质还是化学性质的关键就是看表现物质的性质时是否有新物质产生.可以据此完成(1)和(2)两小题.
(3)根据该气体的物理性质考虑;
(4)根据硫化氢有毒,能溶于水进行分析;
(5)根据实验室制取硫化氢的反应物是固体和液体,反应条件是常温,硫化氢密度比空气大,过氧化氢在二氧化锰的催化作用下生成水和氧气进行分析;
(6)根据实验室用高锰酸钾制取氧气的反应物是固体,反应条件是加热,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气进行分析;
(7)根据图2装置可以通过压强的改变,控制反应的发生和停止进行分析;
(8)根据分液漏斗可以控制液体的滴加速度进行分析.
解答 解:(1)低洼地的人畜死亡率高,说明该气体密度比空气大,头埋在和着烂死的潮湿的草里,却幸免于中毒,说明该气体易溶于水;
(2)高压天然气携带一种有毒气体从地下喷出,所以该气体有毒;点燃了喷出的气体,说明该气体具有可燃性;
(3)因为该气体易溶于水,所以要用湿毛巾捂住口鼻,又因为该气体密度比空气大,所以要向高处跑;
(4)当地政府已经通知下游群众不要饮用河沟水,因为硫化氢能溶于水,有毒;
(5)实验室制取硫化氢的反应物是固体和液体,反应条件是常温,硫化氢密度比空气大,所以发生装置是B,收集装置是D,此装置还可用来制取氧气,过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(6)实验室用高锰酸钾制取氧气的反应物是固体,反应条件是加热,所以发生装置选A,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,要收集到较纯净的氧气应选用E;
(7)图2装置可以通过压强的改变,控制反应的发生和停止,所以改进后该装置的优点是可控制反应随时发生和停止;
(8)分液漏斗可以控制液体的滴加速度.
故答案为:(1)无色有臭鸡蛋气味的气体,能溶或易溶于水,密度比空气大;
(2)有毒,能与碱溶液反应;
(3)湿毛巾堵住口鼻,向高处跑;
(4)硫化氢能溶于水,有毒;
(5)B,D,氧气或二氧化碳或氢气,2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(6)A,反应物状态是固体,反应条件是加热,2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,E;
(7)可控制反应随时发生和停止;
(8)将长颈漏斗改为分液漏斗.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案| A. | 磷在空气中燃烧,有大量白雾生成 | |
| B. | 硫在空气中燃烧,发出明亮的蓝紫色火焰 | |
| C. | 木炭在空气中燃烧,发出白光 | |
| D. | 铁丝在氧气中燃烧,生成一种黑色的固体四氧化三铁 |

| 装置A | 装置B | |
| 反应状态 | 固体反应生成气体 | 固体和液体反应生成气体 |
| 反应条件 | 加热 | 无需加热 |
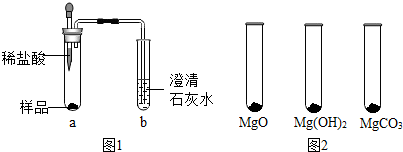
已知:MgO+2HCl═MgCl2+H2O MgCO3+2HCl═MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3.
①取少量样品,如图1所示进行实验,观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有MgCO3.
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭,但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是除掉二氧化碳.小明按照修改后的实验方案重复上述实验,观察到b试管口,证明“镁粉”中不含Mg.
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2.
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验,分别取0.5g三种固体粉末,每次取样方法如图2所示:
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失,在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀盐酸的体积/mL | 10.4 | 7.2 | 5.0 |
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解,此时消耗稀盐酸的体积约为5.3mL.
【实验分析及结论】
“镁粉”不只含有MgCO3,理由是0.5gMgCO3消耗的盐酸体积与0.5g“镁粉”消耗的盐酸体积不相等.
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5gMgCO3,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL,由此可知“镁粉”中含有MgCO3的质量分数为85%,“镁粉”中除MgCO3外的另一种物质为Mg(OH)2.
| A. | 米饭变馊 | B. | 木柴燃烧 | C. | 瓷碗破碎 | D. | 玉米酿酒 |


 水是生命的源泉,也是不可缺少的资源.
水是生命的源泉,也是不可缺少的资源.