题目内容
4.在空气中点燃镁条,镁不但能与氧气反应生成氧化镁,也会与氮气反应生成氮化镁(Mg3N2).某学习小组拟对镁在空气中燃烧后的固体混合物中氮化镁的质量分数进行测定,设计如图实验装置,并进行实验探究: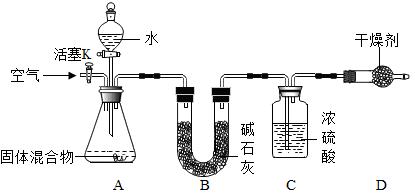
【查阅资料】
Ⅰ.氮化镁与水反应生成氢氧化镁和氨气;
Ⅱ.碱石灰是固体氧化钙和氢氧化钠的混合物,常用作干燥剂,不与NH3反应;
Ⅲ.2NH3+H2SO4═(NH4)2SO4
Ⅳ.NH3是一种极易溶于水的气体.
【实验步骤】①检查装置的气密性;②精确称量镁在空气中燃烧后的固体5.00g放入锥形瓶中,称量装置C,连接好装置;③关闭活塞K,打开A中分液漏斗活塞,逐滴加入水,至样品恰好完全反应;④打开活塞K,鼓入空气;⑤再次称量装置C
请你与他们一起完成下列问题的探究:
(1)检查该装置气密性的方法及现象是:关闭活塞K及分液漏斗活塞,双手手掌紧贴锥形瓶外壁,观察C瓶中有气泡产生,说明该装置不漏气;
(2)装置B和装置D的共同作用是吸收水分,防止装置中气体中的水分和空气中的水分进入C瓶;
(3)实验步骤④鼓入空气的作用是使产生的氨气全部进入C瓶被浓硫酸吸收.
(4)若装置C增重0.34g,固体混合物中Mg3N2的质量分数为20%;
(5)实验证明此方法测定的结果偏低,可能原因是部分氨气溶于水中不能完全排出(写一条).
分析 检查该装置气密性的方法及现象是:关闭活塞K及分液漏斗活塞,双手紧握锥形瓶的外壁,观察C瓶中有气泡产生,说明该装置不漏气;本题能使同学们体会到实验探究的一般过程,通过实验分析可知:装置B和装置D的共同作用是,吸收水分,防止装置中气体中的水分和空气中的水分进入C瓶;实验步骤④鼓入空气的作用是:使产生的氨气全部进入C瓶被浓硫酸吸收;实验证明此方法测定的结果偏低,可能原因是:部分氨气溶于水中不能完全排出.有关化学方程式的计算要准确.
解答 解:(1)检查该装置气密性的方法及现象是:关闭活塞K及分液漏斗活塞,双手紧握锥形瓶的外壁,观察C瓶中有气泡产生,说明该装置不漏气;
(2)装置B和装置D的共同作用是,吸收水分,防止装置中气体中的水分和空气中的水分进入C瓶;
(3)实验步骤④鼓入空气的作用是:使产生的氨气全部进入C瓶被浓硫酸吸收;
(4)设氮化镁的质量分数为x,
Mg3N2+6H20=3Mg(OH)2↓+2NH3↑
100 34
5g•x 0.34g
$\frac{100}{34}=\frac{5g•x}{0.34g}$
x=20%
(5)实验证明此方法测定的结果偏低,可能原因是:部分氨气溶于水中不能完全排出.
故答案为:(1)关闭活塞K及分液漏斗活塞,双手手掌紧贴锥形瓶外壁,观察C瓶中有气泡产生,说明该装置不漏气;
(2)吸收水分,防止装置中气体中的水分和空气中的水分进入C瓶;
(3)使产生的氨气全部进入C瓶被浓硫酸吸收;
(4)20%;
(5)部分氨气溶于水中不能完全排出.
点评 实验探究题是近几年中考的热点之一,它包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验资料和实验分析,得到了正确的结论,属于结论性探究.同学们要具体分析,综合掌握.

| A. | 滴入澄清石灰水,观察是否浑浊 | |
| B. | 将带火星小木条伸入,观察是否复燃 | |
| C. | 加入MnO2,观察是否产生气泡 | |
| D. | 将燃着的小木条伸入,观察是否更旺 |
| A. | Cl-和NO3-一定不在同一工厂 | B. | Na+和NO3-来自同一工厂 | ||
| C. | Ag+和Na+可能在同一工厂 | D. | SO42-和NO3-可能来自同一工厂 |



 ),它的化学式可写作C2H4O.爆炸时,环氧乙烷先成雾状分散在空气中,然后燃爆,反应的生成物为CO、CO2、H2O.
),它的化学式可写作C2H4O.爆炸时,环氧乙烷先成雾状分散在空气中,然后燃爆,反应的生成物为CO、CO2、H2O.