题目内容
20. 为了测定某石灰石矿样的纯度(其中所含杂质不与酸反应),某同学按如下流程进行实验:用盐酸溶解矿样→干燥所得气体→用NaOH溶液吸收气体→根据NaOH溶液的增重量计算矿样的纯度.实验过程中所取矿样的质量为20g.实验装置如图所示:
为了测定某石灰石矿样的纯度(其中所含杂质不与酸反应),某同学按如下流程进行实验:用盐酸溶解矿样→干燥所得气体→用NaOH溶液吸收气体→根据NaOH溶液的增重量计算矿样的纯度.实验过程中所取矿样的质量为20g.实验装置如图所示:(1)A为溶解矿样的装置,若已经准备了长颈漏斗、双孔橡胶塞、导气管,为了完成溶解至少还需要的实验仪器是广口瓶,或锥形瓶,或大试管;
(2)B中所盛的试剂是浓硫酸;
(3)根据上述装置进行实验,下列情况会使实验结果产生偏差的是①②③④;
①实验开始前A、B装置以及导气管内残留有少量空气
②进入C装置的气体中还混有少量HCl气体
③气体通过速度过快,CO2来不及被NaOH溶液全部吸收
④实验结束时,系统内还残留有少量CO2气体
(4)改进实验装置并进行正确操作可以准确测出矿样的纯度,若此时C装置在实验前后其质量增加了6.6g,则该矿样的纯度为75%.
分析 广口瓶、锥形瓶、试管等仪器常用作反应容器;
浓硫酸能够吸收水蒸气,可以用作干燥剂;
如果操作不当,会影响实验结果,甚至会导致实验失败;
二氧化碳能和氢氧化钠反应生成碳酸钠和水,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,根据反应的化学方程式和提供的数据可以进行相关方面的计算.
解答 解:(1)A为溶解矿样的装置,若已经准备了长颈漏斗、双孔橡胶塞、导气管,为了完成溶解至少还需要的实验仪器是广口瓶,或锥形瓶,或大试管.
故填:广口瓶,或锥形瓶,或大试管.
(2)B中所盛的试剂是浓硫酸,用来吸收二氧化碳中的水蒸气.
故填:浓硫酸.
(3)①实验开始前A、B装置以及导气管内残留有少量空气,会导致测定的二氧化碳质量偏大,从而导致测定的碳酸钙质量分数偏大;
②进入C装置的气体中还混有少量HCl气体,氢氧化钠溶液能够吸收氯化氢气体,会导致测定的二氧化碳质量偏大,从而导致测定的碳酸钙质量分数偏大;
③气体通过速度过快,CO2来不及被NaOH溶液全部吸收,会导致测定的二氧化碳质量偏小,从而导致测定的碳酸钙质量分数偏小;
④实验结束时,系统内还残留有少量CO2气体,会导致测定的二氧化碳质量偏小,从而导致测定的碳酸钙质量分数偏小.
故填:①②③④.
(4)设碳酸钙质量为x,
若此时C装置在实验前后其质量增加了6.6g,说明反应生成了6.6g二氧化碳;
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 6.6g
$\frac{100}{x}$=$\frac{44}{6.6g}$,
x=15g,
则该矿样的纯度为:$\frac{15g}{20g}$×100%=75%,
答:该矿样的纯度为75%.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案 为了比较甲、乙两种金属的活动性强弱和相对原子质量大小,小吴同学设计了一套实验装置(如图),他取两种金属(表面积相同)各m克,分别加入足量的稀硫酸(相同质量和质量分数)进行反应,在相同条件下测定不同时间内收集到的气体体积,实验记录如下表:
为了比较甲、乙两种金属的活动性强弱和相对原子质量大小,小吴同学设计了一套实验装置(如图),他取两种金属(表面积相同)各m克,分别加入足量的稀硫酸(相同质量和质量分数)进行反应,在相同条件下测定不同时间内收集到的气体体积,实验记录如下表:| 反应时间(秒) | 20 | 40 | 60 | 80 | 100 | 120 | 140 | |
| 收集到的气体体积(毫升) | 甲金属 | 25 | 60 | 95 | 130 | 160 | 170 | 170 |
| 乙金属 | 30 | 75 | 120 | 150 | 150 | 150 | 150 | |
A.导管口一有气泡冒出时 B.冒出气泡连续且均匀时 C.检验产生的气体纯净时
(2)根据已有实验数据,要比较甲、乙两种金属的相对原子质量大小,还需知道B
A.参加反应的硫酸质量 B.生成物中金属元素的化合价
(3)若甲、乙两金属与硫酸反应的化学方程式配平完全一样相同,根据上表数据分析可知:B、D
A.金属活泼性:甲>乙; B.金属活泼性:甲<乙;
C.相对原子质量:甲>乙; D.相对原子质量:甲<乙.
【实验目的】制取纯净的硫酸钡
【反应原理】Na2SO4+BaCl2═BaSO4↓+2NaCl
【实验步骤】取一定量的硫酸钠和氯化钡溶液反应,过滤、洗涤、干燥得到纯净的硫酸钡.
(1)实验中,能直接观察到说明硫酸钠和氯化钡溶液发生化学反应的证据是:有白色沉淀生成.
(2)判断任一反应物是否完全反应的证据可按如下方法获取:
| 猜想 | 方案 | 证据 | 结论 |
| 氯化钡可能已 完全反应 | 取少量滤液,加入稀硫酸 溶液,观察现象 | 无白色沉淀生成 | 氯化钡已完全反应 |
| 硫酸钠可能已 完全反应 | 取少量滤液,加入氯化钡溶液,观察现象 | 无白色沉淀生成 | 硫酸钠未完全反应 |
| 反应时间t∕s | t0 | t1 | t2 | t3 | t4 |
| 反应后固体的质量m∕g | 6 | 4.24 | 4.16 | 4.08 | 4.08 |
(1)完全反应后产生氧气的质量是多少?
(2)样品中氯酸钾的纯度是多少?
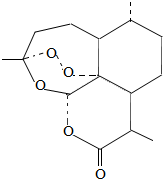 2015年10月,屠呦呦因发现青蒿素治疗疟疾的新疗法获诺贝尔生理学或医学奖.关于青蒿素(化学式为Cl5H22O5)的说法正确的是( )
2015年10月,屠呦呦因发现青蒿素治疗疟疾的新疗法获诺贝尔生理学或医学奖.关于青蒿素(化学式为Cl5H22O5)的说法正确的是( )| A. | 青蒿素由C、H、O三种原子构成 | |
| B. | 28.2g青蒿素中含碳元素的质量为18g | |
| C. | 一个青蒿素分子含有11个氢分子 | |
| D. | C、H、0三种元素的质量比为15:22:5 |
