题目内容
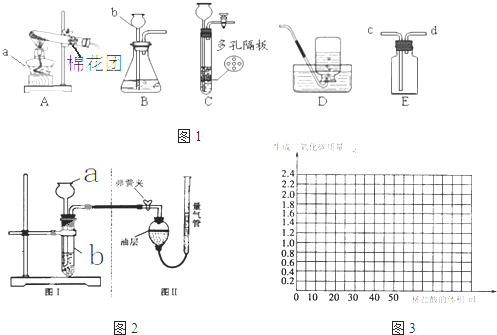
图1所示为实验室常用的实验装置:

(1)常温下,用锌和稀硫酸反应制取氢气,应选用的发生装置是
(2)F装置可用来测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是
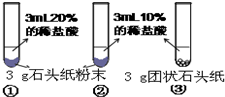
(3)小红发现碳酸钠与盐酸反应也可以产生CO2气体,如图2所示,向烧杯内Na2CO3粉末滴入盐酸,观察烧杯中燃着的小蜡烛.观察下面一支蜡烛的火焰先熄灭,上面一支随后熄灭.
请写出碳酸钠与盐酸反应的化学方程式:
从这个实验说明了CO2具有的性质是:①:
根据以上性质,得出CO2的用途之一是:

(1)常温下,用锌和稀硫酸反应制取氢气,应选用的发生装置是
B
B
(填序号,下同),收集装置是C或D
C或D
;(2)F装置可用来测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是
防止CO2溶于水且与水反应
防止CO2溶于水且与水反应
,植物油上方原有的空气对实验的结果没有
没有
(填“有”或“没有”)明显影响.(3)小红发现碳酸钠与盐酸反应也可以产生CO2气体,如图2所示,向烧杯内Na2CO3粉末滴入盐酸,观察烧杯中燃着的小蜡烛.观察下面一支蜡烛的火焰先熄灭,上面一支随后熄灭.
请写出碳酸钠与盐酸反应的化学方程式:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
;从这个实验说明了CO2具有的性质是:①:
CO2密度比空气大
CO2密度比空气大
;②:CO2不能燃烧,也不能支持燃烧
CO2不能燃烧,也不能支持燃烧
.根据以上性质,得出CO2的用途之一是:
CO2可用于灭火
CO2可用于灭火
.分析:(1)根据反应物的状态和反应条件选择发生装置,并据氢气的密度和溶解性选择收集装置;
(2)根据实验目的及二氧化碳的水溶性进行分析植物油的作用,根据排水法测气体的体积的原理判断空气的影响;
(3)据反应原理书写方程式,并据现象分析二氧化碳的性质,据性质分析其用途.
(2)根据实验目的及二氧化碳的水溶性进行分析植物油的作用,根据排水法测气体的体积的原理判断空气的影响;
(3)据反应原理书写方程式,并据现象分析二氧化碳的性质,据性质分析其用途.
解答:解:(1)常温下,用锌和稀硫酸反应制取氢气,属于固液常温型,故应选用的发生装置是B,氢气密度比空气小且难溶于水,所以可用向下排空气法或排水法收集;
(2)图F是采用排水法测二氧化碳的体积,用量筒测量水的体积从而测二氧化碳的体积;二氧化碳能溶于水,所以要在水的上方放一层植物油,防止二氧化碳溶于水.排水法测气体体积的原理是:利用排出水的体积和进入装置中的气体的体积相等的原理进行的,所以在没有二氧化碳生成时,盛水的集气瓶中压强和外界大气压是相等,当有二氧化碳气体生成时,集气瓶内气体压强增大,将水排出,所以油上方的空气对实验结果没有影响;
(3)碳酸钠和盐酸常温下反应生成氯化钠、二氧化碳气体和水,方程式是Na2CO3+2HCl=2NaCl+H2O+CO2↑;
向烧杯内Na2CO3粉末滴入盐酸,观察烧杯中燃着的小蜡烛.观察下面一支蜡烛的火焰先熄灭,上面一支随后熄灭,说明二氧化碳气体的密度大于空气,不能燃烧、且不支持燃烧,故可用于灭火;
故答案为:(1)B;C或 D;
(2)防止CO2溶于水且与水反应;没有;
(3)Na2CO3+2HCl=2NaCl+H2O+CO2↑;
CO2密度比空气大;CO2不能燃烧,也不能支持燃烧;
CO2可用于灭火.
(2)图F是采用排水法测二氧化碳的体积,用量筒测量水的体积从而测二氧化碳的体积;二氧化碳能溶于水,所以要在水的上方放一层植物油,防止二氧化碳溶于水.排水法测气体体积的原理是:利用排出水的体积和进入装置中的气体的体积相等的原理进行的,所以在没有二氧化碳生成时,盛水的集气瓶中压强和外界大气压是相等,当有二氧化碳气体生成时,集气瓶内气体压强增大,将水排出,所以油上方的空气对实验结果没有影响;
(3)碳酸钠和盐酸常温下反应生成氯化钠、二氧化碳气体和水,方程式是Na2CO3+2HCl=2NaCl+H2O+CO2↑;
向烧杯内Na2CO3粉末滴入盐酸,观察烧杯中燃着的小蜡烛.观察下面一支蜡烛的火焰先熄灭,上面一支随后熄灭,说明二氧化碳气体的密度大于空气,不能燃烧、且不支持燃烧,故可用于灭火;
故答案为:(1)B;C或 D;
(2)防止CO2溶于水且与水反应;没有;
(3)Na2CO3+2HCl=2NaCl+H2O+CO2↑;
CO2密度比空气大;CO2不能燃烧,也不能支持燃烧;
CO2可用于灭火.
点评:本题主要考查学生对实验室制备氧气和二氧化碳的反应原理、发生装置的选择、收集装置的选择及有关气体体积测定方法的掌握情况.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目




 MnCl2+Cl2↑+2H2O,根据以上信息和图2所示的装置图回答有关问题:
MnCl2+Cl2↑+2H2O,根据以上信息和图2所示的装置图回答有关问题: