题目内容
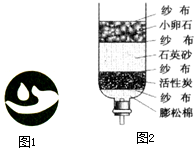
如图1所示为实验室常用的实验装置,回答问题:
(1)写出带有标号仪器①的名称:______
(2)用高锰酸钾制取氧气的反应方程式为______;用排水法收集氧气时水槽中水显紫红色的原因是______.
(3)用锌和稀硫酸制取氢气,应选用的发生装置和收集装置组合是______(填序号),
(4)氯气是一种黄绿色有强烈刺激性气味的剧毒气体,密度大于空气易溶于水,但不溶于饱和食盐水,且极易与氢氧化钠溶液反应.实验室制取氯气的操作步骤是:选择药品→发生装置→除杂装置→收集装置→尾气处理装置.其反应原理是MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,根据以上信息和图2所示的装置图回答有关问题:
MnCl2+Cl2↑+2H2O,根据以上信息和图2所示的装置图回答有关问题:
①你认为适合实验室制取氯气的发生装置是______(填“A”、“B”或“C”)
②除杂装置和吸收装置中药品依次为______(选填a、b、c).
a.浓硫酸 饱和食盐水 氢氧化钠溶液
b.氢氧化钠溶液 浓硫酸 饱和食盐水
c.饱和食盐水 浓硫酸 氢氧化钠溶液
③由于氯气极易溶于氢氧化钠溶液,在此吸收装置中烧杯里试剂很容易倒吸入集气瓶内,为避免此现象的出现,你常用的改进方法是______.
解;(1)仪器①的名称是水槽;
(2)高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,反应的化学方程式是:2KMnO4 K2MnO4+MnO2+O2↑;用高锰酸钾制氧气时,需要在试管口加一团棉花,防止高锰酸钾小颗粒进入导气管而堵塞导气管或进入水槽,使水槽中水显紫红色;
K2MnO4+MnO2+O2↑;用高锰酸钾制氧气时,需要在试管口加一团棉花,防止高锰酸钾小颗粒进入导气管而堵塞导气管或进入水槽,使水槽中水显紫红色;
(3)实验室是用锌粒和稀硫酸在常温下反应制氢气的,因此不需要加热,选择的发生装置是A;氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集;
(4)①实验室制取氯气是用加热二氧化锰和浓盐酸的方法,即反应物为固体和液体,反应的条件为加热,所以应选B装置;
②气体分别通入盛有饱和氯化钠溶液的洗气瓶和盛有浓硫酸的洗气瓶,除杂干燥后用向上排空法收集氯气,氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置收集;
③由于氯气极易溶于氢氧化钠溶液,在此吸收装置中烧杯里试剂很容易通过导气管倒吸入集气瓶内,若在吸收装置的导管口加一个倒置的漏斗,可增大接触面积,防止倒吸现象.
故答案为:(1)水槽;(2)2KMnO4 K2MnO4+MnO2+O2↑; 试管口没有放棉花; (3)AC或AE;
K2MnO4+MnO2+O2↑; 试管口没有放棉花; (3)AC或AE;
(4)①B ②c ③在吸收装置的导管口加一个倒置的漏斗(合理均可).
分析:(1)熟练掌握常见化学仪器的名称及其用途;
(2)高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,写出反应的化学方程式;根据高锰酸钾制取氧气装置的注意事项分析;
(3)根据实验室是用锌粒和稀硫酸在常温下反应制氢气的,选择发生装置;根据氢气难溶于水,密度比空气的密度小,选择收集方法;
(4)①根据反应物的状态和反应条件选择制取氯气的发生装置;
②根据实验的目的结合信息分析;
③在吸收装置的导管口加一个倒置的漏斗,可增大接触面积,防止倒吸现象.
点评:本题考查知识综合而全面,既考查了实验室制取气体的思路及理解应用,同时也考查了仪器的名称和化学方程式的书写,综合性比较强.明确气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.
(2)高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,反应的化学方程式是:2KMnO4
 K2MnO4+MnO2+O2↑;用高锰酸钾制氧气时,需要在试管口加一团棉花,防止高锰酸钾小颗粒进入导气管而堵塞导气管或进入水槽,使水槽中水显紫红色;
K2MnO4+MnO2+O2↑;用高锰酸钾制氧气时,需要在试管口加一团棉花,防止高锰酸钾小颗粒进入导气管而堵塞导气管或进入水槽,使水槽中水显紫红色;(3)实验室是用锌粒和稀硫酸在常温下反应制氢气的,因此不需要加热,选择的发生装置是A;氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集;
(4)①实验室制取氯气是用加热二氧化锰和浓盐酸的方法,即反应物为固体和液体,反应的条件为加热,所以应选B装置;
②气体分别通入盛有饱和氯化钠溶液的洗气瓶和盛有浓硫酸的洗气瓶,除杂干燥后用向上排空法收集氯气,氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置收集;
③由于氯气极易溶于氢氧化钠溶液,在此吸收装置中烧杯里试剂很容易通过导气管倒吸入集气瓶内,若在吸收装置的导管口加一个倒置的漏斗,可增大接触面积,防止倒吸现象.
故答案为:(1)水槽;(2)2KMnO4
 K2MnO4+MnO2+O2↑; 试管口没有放棉花; (3)AC或AE;
K2MnO4+MnO2+O2↑; 试管口没有放棉花; (3)AC或AE;(4)①B ②c ③在吸收装置的导管口加一个倒置的漏斗(合理均可).
分析:(1)熟练掌握常见化学仪器的名称及其用途;
(2)高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,写出反应的化学方程式;根据高锰酸钾制取氧气装置的注意事项分析;
(3)根据实验室是用锌粒和稀硫酸在常温下反应制氢气的,选择发生装置;根据氢气难溶于水,密度比空气的密度小,选择收集方法;
(4)①根据反应物的状态和反应条件选择制取氯气的发生装置;
②根据实验的目的结合信息分析;
③在吸收装置的导管口加一个倒置的漏斗,可增大接触面积,防止倒吸现象.
点评:本题考查知识综合而全面,既考查了实验室制取气体的思路及理解应用,同时也考查了仪器的名称和化学方程式的书写,综合性比较强.明确气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.

练习册系列答案
相关题目
 28、水在实验室和日常生活中有着十分重要的作用.
28、水在实验室和日常生活中有着十分重要的作用.
 (1)水是重要的资源,水资源不足,将严重影响人类生存.请结合下表回答:
(1)水是重要的资源,水资源不足,将严重影响人类生存.请结合下表回答: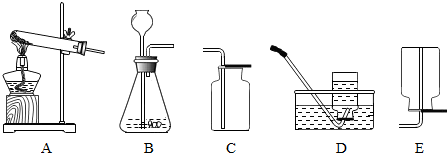
 、
、 、
、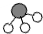 分别表示N2、H2、NH3.在催化剂表面(下图中
分别表示N2、H2、NH3.在催化剂表面(下图中 表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:

 实验室常采用分解H2O2的水溶液(MnO2作催化剂)的方法制取氧气.
实验室常采用分解H2O2的水溶液(MnO2作催化剂)的方法制取氧气.