题目内容
2. 将10%的NaOH溶液逐滴加入到20克稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示,请计算:
将10%的NaOH溶液逐滴加入到20克稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示,请计算:(1)a点溶液中大量存在的离子有Na+、Cl-.(写符号)
(2)当恰好完全反应时,消耗NaOH的质量为1.6克.
(3)计算稀盐酸中溶质的质量分数.
分析 (1)a点时,溶液的pH等于7,说明稀盐酸和氢氧化钠恰好完全反应生成氯化钠和水,溶液中大量存在的离子是钠离子和氯离子;
(2)根据图中信息可以判断当恰好完全反应时,消耗NaOH的质量;
(3)根据氢氧化钠溶液质量、溶质质量分数可以计算氯化氢的质量,进一步可以计算稀盐酸中溶质的质量分数.
解答 解:(1)a点时氢氧化钠与氯化氢恰好反应生成氯化钠,则该溶液中大量存在的离子为:Na+、Cl-,
故答案为:
(2)根据图示可知,两溶液恰好完全反应时消耗NaOH溶液的质量为16g,NaOH的质量为16g×10%=1.6g
故答案为:1.6;
(3)设稀盐酸中氯化氢的质量为x,
NaOH+HCl═NaCl+H2O,
40 36.5
1.6g x
则:$\frac{40}{1.6g}=\frac{36.5}{x}$,
解得:x=1.46g,
稀盐酸中溶质的质量分数为:$\frac{1.46g}{20g}×100%$=7.3%,
稀盐酸中溶质的质量分数是7.3%.
点评 本题考查了酸碱混合的定性判断及计算,题目难度不大,明确中和反应的实质为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
12.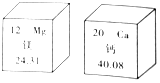 俗话说:“补钙不补镁,补了也后悔”,原来镁有协同钙的作用,会促进钙的吸收.如图是镁、钙在元素周期表中的部分信息,则下列说法不正确的是( )
俗话说:“补钙不补镁,补了也后悔”,原来镁有协同钙的作用,会促进钙的吸收.如图是镁、钙在元素周期表中的部分信息,则下列说法不正确的是( )
 俗话说:“补钙不补镁,补了也后悔”,原来镁有协同钙的作用,会促进钙的吸收.如图是镁、钙在元素周期表中的部分信息,则下列说法不正确的是( )
俗话说:“补钙不补镁,补了也后悔”,原来镁有协同钙的作用,会促进钙的吸收.如图是镁、钙在元素周期表中的部分信息,则下列说法不正确的是( )| A. | 镁和钙都属于金属元素 | B. | 在金属活动性顺序中,镁比钙活泼 | ||
| C. | 镁原子的质子数为12 | D. | 钙的相对原子质量为40.08 |
10.学习化学的目的并不在于人人都要成为化学家,更重要的是学会用化学观点去分析、解决生产生活中的问题.下列说法中,正确的是( )
| A. | 重金属盐能使蛋白质变性起到杀菌作用,因此可用重金属盐溶液浸泡海产品 | |
| B. | 海底蕴藏着大量“可燃冰”,以它为燃料不会对自然界中的碳循环产生影响 | |
| C. | 进入久未开启的地窖,应先做灯火实验 | |
| D. | 夜间发现液化气泄漏应立即开灯检查 |
17.我国科学家屠呦呦及她的团队发现了青蒿素,并运用在医学上,是治疗疟疾的特效药,获得了诺贝尔奖.青蒿素化学式为 C15H22O5,关于青篙素的说法正确的是( )
| A. | 不属于有机物 | |
| B. | C15H22O5中碳元素的质量分数是$\frac{12×5}{12×15+1×22+16×5}$×100% | |
| C. | 一个青篙素分子含有 11 个氢分子 | |
| D. | C、H、O 三种元素的质量比为 15:22:5 |
7. 我国科学家创造性地构建了“单中心铁催化剂”,在甲烷高效转化研究中获得重大突破.其成果在最近的美国《科学》杂志发表.该转化的微观示意图如图,有关转化的说法错误的是( )
我国科学家创造性地构建了“单中心铁催化剂”,在甲烷高效转化研究中获得重大突破.其成果在最近的美国《科学》杂志发表.该转化的微观示意图如图,有关转化的说法错误的是( )
 我国科学家创造性地构建了“单中心铁催化剂”,在甲烷高效转化研究中获得重大突破.其成果在最近的美国《科学》杂志发表.该转化的微观示意图如图,有关转化的说法错误的是( )
我国科学家创造性地构建了“单中心铁催化剂”,在甲烷高效转化研究中获得重大突破.其成果在最近的美国《科学》杂志发表.该转化的微观示意图如图,有关转化的说法错误的是( )| A. | 催化剂改变了反应速率 | B. | 生成物之一为 C2H4 | ||
| C. | 反应前后原子的种类发生了变化 | D. | 反应物与生成物均有分子构成 |
11.下列说法正确的是( )
| A. | 分子可以直接构成物质,则溶质都以分子形式分散到溶剂中形成溶液 | |
| B. | 中和反应生成盐和水,则生成盐和水的反应都是中和反应 | |
| C. | 蜡烛燃烧后质量减轻了,但该反应仍然遵循质量守恒定律 | |
| D. | 一氧化碳、二氧化碳组成元素相同,则一氧化碳、二氧化碳化学性质相同 |
12.建立模型是学习化学的重要方法,下列有关模型正确的是( )
| A. |  原子结构模型 | B. |  物质分类模型 | ||
| C. |  燃烧条件模型 | D. |  空气组成模型 |

