题目内容
4.如表所示对部分化学知识的归纳完全正确的一组是( )| A.化学与生活 | B.化学与环境 |
| ①用灼烧的方法能鉴别尼龙线和羊毛线 ②活性炭能净水是因为活性炭有吸附性 | ①酸雨主要是由CO2、SO2气体引起的 ②PM2.5是造成雾霾天气的“元凶”之一 |
| C.化学与健康 | D.化学与安全 |
| ①发霉的谷物晾晒后即可食用 ②使用加铁酱油可预防贫血 | ①酒精洒在桌上不慎燃烧起来,可以用水浇灭 ②误服重金属盐溶液,喝鸡蛋清或牛奶 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、根据羊毛的主要成分是蛋白质以及活性炭具有吸附性进行解答;
B、根据二氧化碳引起温室效应进行解答;
C、根据发霉的谷物含有黄曲霉毒素进行解答;
D、根据酒精着火不能用水浇灭进行解答.
解答 解:A、点燃燃烧闻气味,有烧焦羽毛气味的是羊毛;有特殊气味,并且起硬球的是尼龙线,活性炭具有吸附性,所以活性炭能净水,故A正确;
B、二氧化碳引起温室效应,而不是引起酸雨,故B错误;
C、发霉的谷物含有黄曲霉毒素,晾晒后也不能食用,故C错误;
D、酒精的密度小于水的密度,所以酒精着火不能用水浇灭,故D错误.
故选A.
点评 本题难度不大,但涉及知识点较多,考查学生对化学知识的掌握程度,采用排除法是正确快捷解答此类题的关键.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
15.有一包白色固体可能含有碳酸钠、硫酸钠、氯化钾、硝酸钡中的一种或几种,某化学兴趣小组的同学为探究其成分,做了以下实验:
①取少量固体于烧杯中,逐渐加水并不断搅拌,烧杯内固体的质量随加入水的质量的变化如图1所示;
②继续向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图2所示.
下列说法中正确的是( )

①取少量固体于烧杯中,逐渐加水并不断搅拌,烧杯内固体的质量随加入水的质量的变化如图1所示;
②继续向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图2所示.
下列说法中正确的是( )

| A. | BC段只能观察到固体逐渐消失 | |
| B. | 从C到D溶液的pH逐渐增大 | |
| C. | B点时,溶液中一定没有碳酸钠和硫酸钠 | |
| D. | 白色固体中一定含有碳酸钠、硫酸钠、硝酸钡 |
12.如图所示各图表示的变化中,只属于物理变化的是( )
| A. |  煤的燃烧 | B. |  火箭发射 | C. |  酸雨侵蚀 | D. |  风力发电 |
19.十八大报告中提到要加快生态文明建设的步伐,下列措施有利于生态文明建设的是( )
①研发易降解的生物农药
②开发生产无汞电池
③田间焚烧秸秆
④应用高效洁净的能源转换技术
⑤加快化石燃料的开采与使用.
①研发易降解的生物农药
②开发生产无汞电池
③田间焚烧秸秆
④应用高效洁净的能源转换技术
⑤加快化石燃料的开采与使用.
| A. | ①③⑤ | B. | ①②④ | C. | ②③⑤ | D. | ②④⑤ |
14.叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究.
【查阅资料】:
①NaN3受撞击会迅速分解生成Na、N2,写出该反应的化学方程式2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑.
②NaN3遇盐酸、H2SO4溶液无气体生成;
③碱石灰是CaO和 NaOH的混合物;
④NaN3工业上制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X;则X的化学式为NH3.
【问题探究】:(一)测定某工业级NaN3样品中Na2CO3的质量分数
(1)工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示)2NaOH+CO2═Na2CO3+H2O;
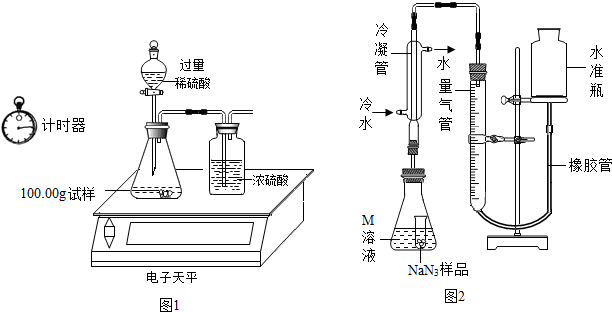
(2)某同学设计如图1装置测出碳酸钠的质量分数,其实验数据记录如表:
①写出锥形瓶中发生的反应方程式:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
②若无浓硫酸的洗气装置,会使测定的结果偏大(填“偏大”、“偏小”或“不变”);
③利用表中数据计算出碳酸钠的质量分数为5.3%.
【问题探究】:(二)测定某工业级样品中NaN3的质量分数
小谈同学精确称量0.140g NaN3样品,设计如图2装置测定其质量分数.
已知2NaN3→3N2(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热.
(1)检查该装置气密性的方法是:连接好装置,从水准管注水,左右两边出现稳定的液面差,说明气密性良好.
(2)使用冷水冷凝的目的是:使水蒸气液化(或除去水蒸气);.
(3)倾斜锥形瓶使小试管中的NaN3样品与M溶液接触充分反应. 常温下测得量气管读数为67.2mL(N2的密度为1.25g/L),则实验中选用的量气管规格合适的是A(填字母序号).
A.100mL B.1L C.2L
(4)计算工业级样品中NaN3的质量分数(写出计算过程,结果保留0.1%).
【查阅资料】:
①NaN3受撞击会迅速分解生成Na、N2,写出该反应的化学方程式2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑.
②NaN3遇盐酸、H2SO4溶液无气体生成;
③碱石灰是CaO和 NaOH的混合物;
④NaN3工业上制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X;则X的化学式为NH3.
【问题探究】:(一)测定某工业级NaN3样品中Na2CO3的质量分数
(1)工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示)2NaOH+CO2═Na2CO3+H2O;
(2)某同学设计如图1装置测出碳酸钠的质量分数,其实验数据记录如表:
| 称量项目 | 称量时间 | 质量(g) |
| 试样 | 100.00 | |
| 装置+稀硫酸质量 | 241.20 | |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 339.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 339.00 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 339.00 |
②若无浓硫酸的洗气装置,会使测定的结果偏大(填“偏大”、“偏小”或“不变”);
③利用表中数据计算出碳酸钠的质量分数为5.3%.
【问题探究】:(二)测定某工业级样品中NaN3的质量分数
小谈同学精确称量0.140g NaN3样品,设计如图2装置测定其质量分数.
已知2NaN3→3N2(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热.
(1)检查该装置气密性的方法是:连接好装置,从水准管注水,左右两边出现稳定的液面差,说明气密性良好.
(2)使用冷水冷凝的目的是:使水蒸气液化(或除去水蒸气);.
(3)倾斜锥形瓶使小试管中的NaN3样品与M溶液接触充分反应. 常温下测得量气管读数为67.2mL(N2的密度为1.25g/L),则实验中选用的量气管规格合适的是A(填字母序号).
A.100mL B.1L C.2L
(4)计算工业级样品中NaN3的质量分数(写出计算过程,结果保留0.1%).

 如图表示NaCl、Na2CO3、AgNO3、BaCl2、HCl五种溶液之间的部分反应关系,线条相连的溶液之间可以发生化学反应.
如图表示NaCl、Na2CO3、AgNO3、BaCl2、HCl五种溶液之间的部分反应关系,线条相连的溶液之间可以发生化学反应. 用图所示装置分离CO和CO2 的混合气体,回答下列问题(提示:实验所用试剂均为足量):
用图所示装置分离CO和CO2 的混合气体,回答下列问题(提示:实验所用试剂均为足量):