题目内容
15.称取8g氯化钠与碳酸钠的固体混合物与50g的稀盐酸恰好完全反应,反应后的溶液质量为55.8g.试求:(1)反应生成的气体质量;
(2)盐酸的溶质质量分数.
分析 (1)根据质量守恒定律计算生成二氧化碳气体的质量;
(2)根据二氧化碳的质量计算参加反应的盐酸的质量,进而计算盐酸的溶质质量分数.
解答 解:(1)碳酸钠和盐酸反应生成二氧化碳,所以二氧化碳的质量为:50g+8g-55.8g=2.2g;
(2)设参加反应的盐酸的质量为x,
Na2CO3 +2HCl=2NaCl+H2O+CO2↑
73 44
x 2.2g
$\frac{73}{x}$=$\frac{44}{2.2g}$
x=3.65g
所以盐酸的溶质质量分数为:$\frac{3.65g}{50g}$×100%=7.3%.
故答案为:(1)2.2g;
(2)7.3%.
点评 本题主要考查了根据化学方程式的计算,了解所得溶液中溶质包括固体中原有的氯化钠和生成的氯化钠是解题的关键,也可利用差量法来解答.

练习册系列答案
相关题目
10.以下说法不正确的是( )
①有单质和化合物生成的反应一定是置换反应
②通过化合、分解、置换和复分解反应均可制得水
③凡均一、稳定、透明、澄清的液体一定是溶液
④棉花、羊毛、塑料和天然橡胶等均属于天然有机高分子材料.
①有单质和化合物生成的反应一定是置换反应
②通过化合、分解、置换和复分解反应均可制得水
③凡均一、稳定、透明、澄清的液体一定是溶液
④棉花、羊毛、塑料和天然橡胶等均属于天然有机高分子材料.
| A. | ①② | B. | ③④ | C. | ①③④ | D. | ①②③④ |
6.关于分子、原子的说法正确的是( )
| A. | 原子是最小的粒子 | |
| B. | 分子、原子都可以直接构成物质 | |
| C. | 蔗糖溶于水是由于蔗糖分子变成了水分子 | |
| D. | 原子的体积小于分子的体积 |
3.在60℃时,硝酸钾的溶解度为110g.该温度下硝酸钾饱和溶液中有关质量关系正确的是( )
| A. | 溶质质量:溶剂质量=1:10 | B. | 溶质质量:溶液质量=10:21 | ||
| C. | 溶剂质量:溶液质量=10:21 | D. | 溶液质量:溶质质量=21:10 |
10.下列实验现象描述正确的是( )
| A. | 红磷在空气中燃烧产生白雾 | B. | 木炭燃烧后生成黑色固体 | ||
| C. | 铁丝在空气中剧烈燃烧 | D. | 硫燃烧后生成有刺激性气味的气体 |
20.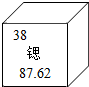 美国物理学家研制出迄今最精确的“锶晶格原子钟”,运行50亿年也不会偏差1秒.根据如图,下列说法正确的是( )
美国物理学家研制出迄今最精确的“锶晶格原子钟”,运行50亿年也不会偏差1秒.根据如图,下列说法正确的是( )
 美国物理学家研制出迄今最精确的“锶晶格原子钟”,运行50亿年也不会偏差1秒.根据如图,下列说法正确的是( )
美国物理学家研制出迄今最精确的“锶晶格原子钟”,运行50亿年也不会偏差1秒.根据如图,下列说法正确的是( )| A. | 锶原子的中子数是38 | |
| B. | 锶的元素符号为SR | |
| C. | 锶元素原子的相对原子质量为87.62g | |
| D. | 锶这种物质由原子构成 |
7.下列正确的是( )
| A. | 质子数的微粒一定是同种元素 | |
| B. | 核外电子数相等的微粒一定是同一种元素 | |
| C. | 含有氧元素的化合物一定是氧化物 | |
| D. | Na和NaCl中的钠元素化合价分别为0和+1 |
4.使用一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品.分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):
(1)表中X的值为3.08;
(2)求样品中碳酸钙的质量分数;(写出详细的计算过程)
(3)烧杯④中物质充分反应后所得溶液的质量为43.92g.
| 烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ | |
| 加入样品的质量/g | 10 | 10 | 10 | 10 | 10 |
| 加入稀盐酸的质量/g | 10 | 20 | 30 | 40 | 50 |
| 充分反应后生成气体的质量/g | 1.1 | 2.2 | X | 3.08 | 3.08 |
(2)求样品中碳酸钙的质量分数;(写出详细的计算过程)
(3)烧杯④中物质充分反应后所得溶液的质量为43.92g.
5.氢气是一种绿色能源,科学家们最新研制出利用太阳能产生激光,再用激光使海水分解得到H2的新技术,其中海水分解可用文字表达式:水$\frac{\underline{\;TiO_{2}\;}}{激光}$氢气+氧气 表示,则下列说法正确的是( )
| A. | 反应物是水和TiO2 | B. | 水分解产物不污染环境 | ||
| C. | 这个反应是化合反应 | D. | 该技术现在可以在普通家庭普及了 |