题目内容
3.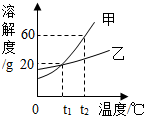 如图所示为甲、乙两物质的溶解度曲线,请你根据曲线回答以下问题:
如图所示为甲、乙两物质的溶解度曲线,请你根据曲线回答以下问题:(1)t2℃时,35g甲物质加入50g水中,充分溶解后所得溶液是饱和溶液(填“饱和”或“不饱和”);
(2)t2℃时乙的某不饱和溶液降温到t1℃时恰好达到饱和状态,该过程中溶质的质量分数不变(填“减小”、“不变”或“增大”);
(3)将t2℃时甲、乙晶体的饱和溶液分别蒸发等量水后,恢复至t2℃,甲溶液析出晶体的质量>(填“>”、“=”或“<”)乙溶液析出的晶体的质量.
分析 根据题目信息和溶解度曲线可知:甲、乙两种固体物质的溶解度,都是随温度升高而增大,而甲的溶解度随温度的升高变化比乙大;t2℃时,甲的溶解度是60g,那么35g甲物质加入50g水中,充分溶解后所得溶液是饱和溶液,并且烧杯底部有固体;t2℃时,乙的某不饱和溶液降温到t1℃时恰好达到饱和状态,该过程中溶质的质量分数不变,因为降温之后溶质质量和水的质量都不变;将t2℃时甲、乙晶体的饱和溶液分别蒸发等量水后,恢复至t2℃,甲溶液析出晶体的质量大于乙溶液析出的晶体的质量,因为在该温度下,甲的溶解度大于乙的溶解度.
解答 解:(1)t2℃时,甲的溶解度是60g,那么35g甲物质加入50g水中,充分溶解后所得溶液是饱和溶液,并且烧杯底部有固体;故答案为:饱和;
(2)t2℃时,乙的某不饱和溶液降温到t1℃时恰好达到饱和状态,该过程中溶质的质量分数不变,因为降温之后溶质质量和水的质量都不变;故答案为:不变;
(3)将t2℃时甲、乙晶体的饱和溶液分别蒸发等量水后,恢复至t2℃,甲溶液析出晶体的质量大于乙溶液析出的晶体的质量,因为在该温度下,甲的溶解度大于乙的溶解度;故答案为:>;
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的计算,有关的计算要准确,本考点主要出现在选择题和填空题中.

练习册系列答案
相关题目
14.下列做法及解释正确的是( )
| A. | 油和水中加洗洁精是溶解现象 | |
| B. | 钢丝球刷洗铝制炊具使其光亮耐用 | |
| C. | 食物滴加碘酒变蓝则含有淀粉 | |
| D. | 火腿中加大量亚硝酸钠保持肉质鲜美 |
11.下列各选项中前者是纯净物,后者是混合物的是( )
| A. | 氢氧化钠 稀盐酸 | B. | 碘酒 碘化钾 | ||
| C. | 空气 氧气 | D. | 海水 石灰水 |
18.如图所示的是初中化学中的一些重要实验,有关这些实验的说法不正确的是( )
| A. |  实验能够证明二氧化碳密度比空气大 | |
| B. |  实验能证明空气中氧气的含量 | |
| C. |  实验能证明锌在金属活动顺序表氢前面 | |
| D. |  实验说明铁有可燃性 |
15.下列图象分别于选项中的操作相对应,其中不合理的是( )
| A. | 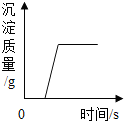 向一定量的盐酸和CaCl2混合溶液中的第如Na2CO3溶液 | |
| B. | 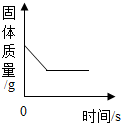 加热氯酸钾和二氧化锰的混合物 | |
| C. | 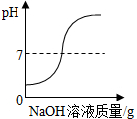 向一定量的盐酸中滴入NaOH溶液 | |
| D. | 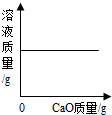 一定温度时,向一定量的饱和石灰水中加入生石灰 |
13.甲、乙两种化合物都是由X、Y两种元素组成.已知甲的化学式为XY2,甲、乙两化合物中X的质量分数分别是30.4%和25.9%.则乙的化学式为( )
| A. | XY | B. | X2Y | C. | X2Y5 | D. | X2Y3 |
