题目内容
19.核电荷数为1~18的元素的原子结构示意图等信息如图,回答下列问题: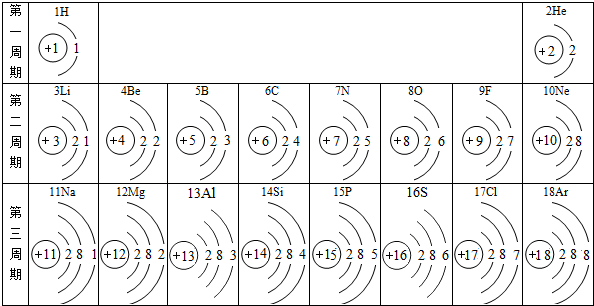
(1)在第三周期中,各原子结构的共同之处是原子核外电子层数相同;该周期中,各原子核外电子排布的变化规律是最外层电子数依次增加.
(2)表中不同种元素最本质的区别是A(填序号).
A.质子数不同 B.中子数不同 C.相对原子质量不同
(3)仅由1、7、8号元素中的三种组成的一种盐的化学式为NH4NO3.
分析 (1)根据元素周期数与电子层数的关系、同一周期原子核外电子排布的变化进行分析解答.
(2)根据元素的概念来分析;
(3)根据题中信息结合盐的概念进行分析.
解答 解:(1)在第三周期中,各原子结构的共同之处是原子核外电子层数相同;该周期中,从左到右,各原子核外电子排布的变化规律是最外层电子数依次增加;故填:原子核外电子层数相同;最外层电子数依次增加;
(2)根据不同种元素最本质的区别是质子数不同,
故填:A
(3)1、7、8号元素分别为氢、氮、氧,这三种可组成的盐是硝酸铵,其化学式NH4NO3;
故填:NH4NO3
点评 了解元素周期表的特点及其应用;了解化学式的书写及意义是解题的关键.

练习册系列答案
相关题目
9.下列实验操作正确且通常可达到实验目的是( )
| A. | 用湿润的pH试纸测量某溶液的pH值 | |
| B. | 欲配制质量分数为10%的CuSO4溶液,将10gCuSO4•5H2O溶解在90g水中 | |
| C. | 用玻璃棒搅拌漏斗中的液体以加快过滤速度 | |
| D. | 实验室不能用排空气法收集CO,但可用排水法收集 |
11.金属钛(Ti)的合金具有耐高温、耐腐蚀、强度高等性能,所以,钛合金广泛用于航空、航天工业及化学工业.工业上冶炼金属钛的过程是以钛矿石(主要成分为钛酸亚铁,化学式为FeTiO3)、焦炭、氯气为原料,在高温条件下制取TiCl4,其反应的化学方程式为2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2TiCl4+2X+6CO.然后用镁与TiCl4在高温条件下反应生成金属钛.根据以上信息,下列判断正确的是( )
| A. | FeTiO3中Ti的化合价为+3 | B. | X是Ti | ||
| C. | FeTiO3中Ti的化合价为+4, | D. | X是Fe |
9.下列四种物质中,属于化合物的是( )
| A. | 液氧 | B. | 生铁 | C. | 蒸馏水 | D. | 食盐溶液 |
 (1)如图信息,瓶中溶液长期放置后溶质质量分数变小,是因为该物质具有吸水性.
(1)如图信息,瓶中溶液长期放置后溶质质量分数变小,是因为该物质具有吸水性. 如图是某保健品标签的部分内容,请仔细阅读后回答下列问题.
如图是某保健品标签的部分内容,请仔细阅读后回答下列问题.