题目内容
碳酸钙在高温下煅烧一段时间后,得到白色固体(CaCO3
CaO+CO2↑),为了确定白色固体的成分,对其可能的组成进行探究,请你完成表格.
试根据上述实验方案进行实验,写出可能发生反应的化学方程式(写一个即可). .
| ||
| 假设(猜想) | 验证方法及操作 | 可能看到的现象 | 结论 |
| 取少量固体滴加 |
是CaCO3和CaO 的混合物 | ||
| 取少量固体滴加 |
只有CaO |
考点:盐的化学性质,生石灰的性质与用途,书写化学方程式、文字表达式、电离方程式
专题:常见的盐 化学肥料
分析:碳酸钙高温煅烧,得到氧化钙和二氧化碳;二氧化碳为气体,逸出.碳酸钙为白色固体,分解生成的氧化钙也为白色固体.两物质的组成中都含有相同的元素钙,不同的是阴离子一为碳酸根、一为氧离子.则本题相当于选择试剂鉴别碳酸根和氧离子.二者可以用强酸的氢离子来区分.碳酸根变成水和二氧化碳气体;氧离子直接结合成水.
解答:解:碳酸钙高温锻烧分解生成白色固体氧化钙,而当锻烧不充分时会在氧化钙中混有未分解的碳酸钙,所以,白色固体可猜为只有氧化钙或氧化钙与碳酸钙的混合物;
可通过向白色固体中滴加稀盐酸的方法检验是否含有碳酸钙:滴加稀盐酸,有气泡冒出,说明固体中含有未分解的碳酸钙;没有气泡冒出,说明固体中只含有氧化钙;碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
故答案为:
;CaCO3+2HCl═CaCl2+H2O+CO2↑.
可通过向白色固体中滴加稀盐酸的方法检验是否含有碳酸钙:滴加稀盐酸,有气泡冒出,说明固体中含有未分解的碳酸钙;没有气泡冒出,说明固体中只含有氧化钙;碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
故答案为:
| 假设(猜想) | 验证方法及操作 | 可能看到的现象 | 结论 |
| 可能是CaCO3和CaO | 取少量固体于试管中滴入稀盐酸 | 有气泡 | 是CaCO3和CaO的混合物 |
| 可能是CaO | 取少量固体于试管中滴入稀盐酸 | 无气泡 | 只有CaO |
点评:此类问题处理的一般思路:根据反应物是否完全反应,可对反应后所得到的物质的成分进行猜想,再依据所猜想的组成物质的性质,设计实验实验进行猜想的验证.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
原子、分子、离子都是构成物质的微粒,下列物质由阴、阳离子构成的是( )
| A、干冰 | B、金刚石 |
| C、黄金 | D、硫酸铜 |
 “2014青岛世园会”于4月25日正式开园,主题是“让生活走进自然”,倡导人与自然和谐相处的绿色发展理念.
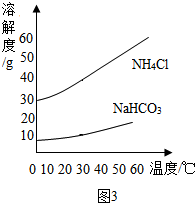
“2014青岛世园会”于4月25日正式开园,主题是“让生活走进自然”,倡导人与自然和谐相处的绿色发展理念.

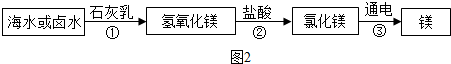
 南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源.
南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源.