题目内容
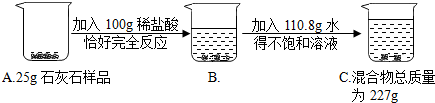
8.100g稀盐酸与25g石灰石恰好完全反应(石灰石中的杂质与盐酸不反应,也不溶于水),生成8.8g二氧化碳,求:(1)盐酸的质量分数.
(2)石灰石中碳酸钙的质量分数.
(3)反应后溶液中溶质的质量分数.
分析 根据碳酸钙和盐酸反应的化学方程式由二氧化碳求算反应物和生成物,题目中100和25
都是含杂物质的质量,不可以用于方程式的计算.反应后的溶液可以采取溶质加溶剂的计算方式,也可以采取反应前的物质减去不溶性物质和生成的气体或沉淀的方式.
解答 解:设生成8.8g二氧化碳时消耗的HCl的质量为x,碳酸钙的质量为y,同时生成的氯化钙的质量为z,生成的水的质量为m(本数据求算针对的是反应溶液质量的第一种求算方式).
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 18 44
y x z m 8.8g
$\frac{100}{y}$=$\frac{73}{x}$=$\frac{111}{z}$=$\frac{18}{m}$=$\frac{44}{8.8g}$
x=14.6g
y=20g
z=22.2g
m=3.6g
盐酸中溶质的质量分数$\frac{14.6g}{100g}$×100%=14.6%
石灰石样品中碳酸钙的质量分数$\frac{20g}{25g}$×100%=80%
反应后溶液中溶质的质量分数
方法一:采取溶质加溶剂的计算方式
反应后溶液中溶质的质量分数=$\frac{22.2g}{22.2g+3.6g(生成的水)+(100g-14.6g)(盐酸中的水)}$×100%≈20%
方法二:采取反应前的物质减去不溶性物质和生成的气体或沉淀的方式.
反应后溶液中溶质的质量分数=$\frac{22.2g}{20g+100g-8.8g}$×100%≈20%
答:(1)盐酸的质量分数为14.6%.
(2)石灰石中碳酸钙的质量分数80%.
(3)反应后溶液中溶质的质量分数20%.
点评 反应后的溶液可以采取溶质加溶剂的计算方式,也可以采取反应前的物质减去不溶性物质和生成的气体或沉淀的方式.

| A. | 湿衣服放在阳光充足的地方很快变干了 | |
| B. | 用蒸馏的方法得到淡水 | |
| C. | 水通直流电后两个电极上有气泡冒出 | |
| D. | 蔗糖溶于水,水变甜了 |
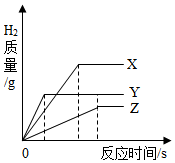 将相同体积,相同溶质质量分数的稀硫酸,分别加入到等质量颗粒大小相同的X、Y、Z3种较活泼金属(金属完全反应),生成H2的质量与反应时间的关系如图;下列说正确的是( )
将相同体积,相同溶质质量分数的稀硫酸,分别加入到等质量颗粒大小相同的X、Y、Z3种较活泼金属(金属完全反应),生成H2的质量与反应时间的关系如图;下列说正确的是( )| A. | 消耗稀盐酸的质量顺序为 Z>Y>X | B. | 产生H2的速率顺序为X>Y>Z | ||
| C. | 3种金属的活动性顺序为Y>X>Z | D. | 相对原子质量有大到小顺序X>Y>Z |
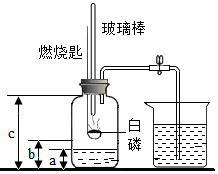 某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下:
某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下: