题目内容
3.为测石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙质量分数,进行如图所示实验.计算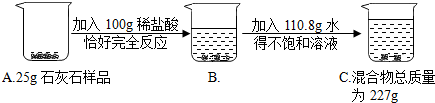
(1)实验中观察到的现象是有气泡产生
(2)反应生成CO2的质量为8.8g
(3)25g石灰石样品中碳酸钙的质量为20g,样品中碳酸钙的质量分数为80%
(4)100g稀盐酸中溶质是氯化氢,质量为14.6g.溶剂是水,其质量为85.4g
(5)反应后所得溶液中溶质是氯化钙溶质质量为22.2g
(6)C烧杯溶液的质量为222g,C烧杯溶液的溶质质量分数为10%.
分析 根据质量守恒定律计算生成二氧化碳的质量,然后依据碳酸钙和盐酸反应的化学方程式计算参加反应的碳酸钙的质量、盐酸的质量,生成氯化钙的质量,然后计算题中相关的数据.
解答 解:(1)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,所以实验中观察到的现象是有气泡产生;
(2)依据质量守恒定律可知,反应生成CO2的质量为:25g+100g+110.8g-227g=8.8g;
(3)设参加反应的碳酸钙的质量为x,参加反应的盐酸的质量为y,生成氯化钙的质量为z
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
x y z 8.8g
$\frac{100}{x}$=$\frac{73}{y}$=$\frac{111}{z}$=$\frac{44}{8.8g}$
x=20g
y=14.6g
z=22.2g
所以碳酸钙的质量分数为:$\frac{20g}{25g}$×100%=80%;
盐酸的溶质质量分数为:$\frac{14.6g}{100g}$×100%=14.6%;
C烧杯溶液的质量为100g+20g+110.8g-8.8g=222g,C烧杯溶液的溶质质量分数为:$\frac{22.2g}{222g}$×100%=10%.
故答案为:(1)有气泡产生;
(2)8.8g;
(3)20,80%;
(4)氯化氢,14.6,水,85.4;
(5)氯化钙,22.2;
(6)222,10%.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
14.能区分CaCO3、NaCl、CaO这三种物质的简单方法是( )
| A. | 稀盐酸 | B. | 水 | C. | 加强热 | D. | CaCl2溶液 |
18.现有一定质量的甲烷(CH4)不完全燃烧,生成一氧化碳、二氧化碳和水蒸气的混合气体60g,经测定混合气体中碳元素的质量分数为20%,则参加反应的氧气的质量是( )
| A. | 16 g | B. | 32g | C. | 22 g | D. | 44 g |
15.为测定石灰石样品的纯度(样品中的杂质既不溶于水也不与盐酸反应,且耐高温).取10g该石灰石样品,再把100g盐酸平均分4次加入样品中,充分反应后剩余固体的质量见下表:
求:(1)哪几次反应盐酸有剩余?
(2)石灰石样品的纯度.
(3)所用盐酸的溶质的质量分数.
| 加稀盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体的质量 | 6.575g | 3.15g | 1.5g | 1.5g |
(2)石灰石样品的纯度.
(3)所用盐酸的溶质的质量分数.
17.下列化学方程式的书写完全正确的是( )
| A. | C+O2$\frac{\underline{\;点燃\;}}{\;}$ CO2↑ | B. | 4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5 | ||
| C. | Mg+O2$\frac{\underline{\;点燃\;}}{\;}$ MgO2 | D. | HgO═Hg+O2 |

 某同学为了证明CO2的性质设计了如图的实验,请回答:
某同学为了证明CO2的性质设计了如图的实验,请回答: