题目内容
9.化学实验是同学们学好化学的重要方法: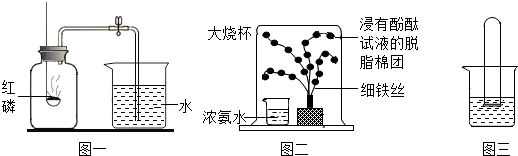
(1)为测定空气里氧气的含量,甲、乙两个同学用如图一所示的装置分别进行了实验探究.
甲同学:点燃红磷立即伸入瓶中并塞上瓶塞,待红磷燃烧停止并冷却后,打开止水夹,观察到集气瓶中吸入水的体积约占集气瓶容积的$\frac{1}{5}$,若实验观察到进水量小于此数值,则可能的原因是装置漏气,红磷量不足(填写其中的两个).
乙同学:用碳替代红磷,完成上述实验,发现集气瓶内并没有吸入水,其原因是碳燃烧生成物是二氧化碳气体,瓶内气压不变.
(2)图二所示实验可观察到“铁树”上浸有无色酚酞试液的棉团由白色变为红色,该实验中没有涉及的性质是B(填字母).
A.氨分子是不断运动的 B.氨分子有一定质量 C.浓氨水具有挥发性
(3)如图三所示,烧杯中盛有一定量的水,向水中滴入几滴紫色石蕊试液,将一装满CO2气体倒扣在水中,一段时间后试管中液面上升且液体变成红色,这一过程中发生的反应化学方程式为CO2+H2O=H2CO3,属于化合反应(填基本反应类型).
分析 (1)根据测定空气中氧气的含量的原理是燃烧物消耗空气中的氧气,然后生成物几乎不占空间,从而造成气压差,则进入的水就是消耗的氧气的量进行分析;
(2)从①浓氨水具有挥发性,挥发出的氨气是由氨分子构成的;②酚酞试液是一种酸碱指示剂,遇酸不变色,遇碱变红色;③氨水是碱性的,能够使酚酞试液变红;④保持物质化学性质的最小粒子是分子,保持氨气的化学性质的最小粒子是氨分子分析解答;
(3)二氧化碳能与水化合生成了碳酸,碳酸显酸性,能使紫色石蕊试液变成红色.据此分析回答有关的问题.
解答 解:(1)①因为红磷燃烧消耗空气中的氧气,氧气约占空气体积的$\frac{1}{5}$,故集气瓶中吸入水的体积约占集气瓶容积的$\frac{1}{5}$,根据在测定空气中氧气的体积分数时注意事项:装置的气密性要好;为了要耗尽瓶中的氧气,红磷必须是足量的;气体的体积受到温度的影响,要等到装置冷却至室温,再打开了弹簧夹等;因此可知达不到瓶中空气总体积的五分之一的原因可能是:装置漏气或红磷量不足或容器未冷却就打开止水夹.
②测空气中氧气的含量主要是根据物质燃烧消耗空气中的气体造成气压减小,减小的体积就是氧气的体积,故生成物中不能有气体,用碳代替红磷,碳燃烧生成物是二氧化碳气体,瓶内气压不变,故不会进入水;
(2)①浓氨水具有挥发性,挥发出的氨气是由氨分子构成的;②酚酞试液是一种酸碱指示剂,遇酸不变色,遇碱变红色;③氨水是碱性的,能够使酚酞试液变红;④由于分子是不断运动的,当氨分子运动到浸有无色酚酞试液的棉团时,和酚酞试液观接触,由于保持物质化学性质的最小粒子是分子,保持氨气的化学性质的最小粒子是氨分子;氨分子能使“铁树”上浸有无色酚酞试液的棉团由白色变成红色;
(3)向盛有紫色石蕊试液的试管中通入适量的CO2,紫色石蕊试液变成红色,是因为二氧化碳与水反应生成碳酸,生成的碳酸使紫色石蕊试液变成红色,反应的化学方程式为CO2+H2O=H2CO3;反应符合“多变一”的特点,属于化合反应.
故答案为:(1)①$\frac{1}{5}$;装置漏气; 红磷量不足或容器未冷却就打开止水夹; ②碳燃烧生成物是二氧化碳气体,瓶内气压不变.
(2)红;B;
(3)CO2+H2O=H2CO3;化合反应.
点评 本题考查了常见物质的性质,完成此题,可以依据已有的知识进行.

| A. | FeO | B. | Fe3O4 | C. | Fe2O3 | D. | Fe2O |
| 物 质 | 样 品 | 加入稀盐酸质量 | 反应后容器中物质的总质量 |
| 质量(g) | 6 | 40 | 43.8 |
试计算:(1)反应生成二氧化碳的质量;
(2)纯碱样品中碳酸钠的质量分数;
(3)小慧同学提出用以上方法计算所得碳酸钠的质量分数偏大,她的理由是盐酸易挥发,部分氯化氢挥发出来,导致计算出的二氧化碳质量偏大,从而导致计算的碳酸钠质量分数偏大.
| A. | 水的沸腾 | B. | 蔗糖溶解 | C. | 蜡烛燃烧 | D. | 干冰升华 |


 ;
;