题目内容
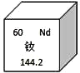
【题目】化学小组同学在帮实验员整理药品时,发现一瓶标签残缺的无色溶液(如图1所示),为确定其中溶质的成分,进行了如下探究活动。
(做出猜想)
根据标签内容,推测溶质可能为NaOH、NaCl、Na2SO4、NaNO3、Na2CO3、 NaHCO3中的一种。
(查阅资料)上述六种物质的相关信息如表:
物质 | NaOH | NaCl | Na2SO4 | NaNO3 | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 109 | 36 | 19.5 | 87 | 21.5 | 9.6 |
水溶液的酸碱性 | 碱性 | 中性 | 中性 | 中性 | 碱性 | 碱性 |
(分析讨论)小组同学一致认为,溶液中的溶质不可能是 NaHCO3,其理由是___________。
(实验探究)小组同学对其余五种猜想继续进行探究。
实验操作 | 测定结果或现象 | 得出结论 |
取少量待测液于试管中,测溶液的pH | PH>7 | 溶质不可能是______ |
取少量待测液于试管中,加入2mL稀盐酸 | 观察到_______ | 溶质是碳酸钠 |
(反思交流)
小红结合药品的存放环境进行分析,认为溶液中的碳酸钠还有可能是氬氧化钠变质产生的,其变质的化学方程式为__________。因,溶液中的溶质可能有两种情况:第一种情况是只含Na2CO3:第二种情况是含有________。
(进一步探究)

为最后确定溶液中溶质的成分,小组同学按如图2所示过程进行实验(已知CaCl2溶液呈中性),步骤③中观察到溶液为________色,因此确认第二种情况成立。
(总结提高)
倾倒液体药品时,为防止标签损坏,应注意 _______,且药品取用完毕后应及时盖好瓶塞。
【答案】室温时,碳酸氢钠的饱和溶液质量分数小于15% 氯化钠、硫酸钠、硝酸钠 产生气泡 ![]() 氢氧化钠和碳酸钠 红 标签向着掌心
氢氧化钠和碳酸钠 红 标签向着掌心
【解析】
[分析讨论] ![]() ,室温时饱和碳酸氢钠溶液质量分数为:
,室温时饱和碳酸氢钠溶液质量分数为:![]() ×100%=8.8%,其溶液中溶质的质量分数小于15%,因此溶液中的溶质不可能是NaHCO3;
×100%=8.8%,其溶液中溶质的质量分数小于15%,因此溶液中的溶质不可能是NaHCO3;
[实验探究]
取少量待测液于试管中,测溶液的pH大于7,溶液呈碱性,氯化钠、硫酸钠、硝酸钠都显中性,溶质不可能是氯化钠、硫酸钠、硝酸钠;取少量待测液于试管中,加入2mL稀盐酸产生气泡,证明溶质是碳酸钠,因碳酸钠和盐酸反应生成二氧化碳,产生气泡;
[反思交流]
溶液中的碳酸钠还有可能是氢氧化钠变质产生的,这是因为氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水,其变质的化学方程式为:2NaOH+CO2═Na2CO3+H2O;
因此,溶液中的溶质可能有两种情况:第一种情况是只含Na2CO3;第二种情况是含有氢氧化钠和碳酸钠.
[进一步探究]
碳酸钠和氯化钙反应生成碳酸钙沉淀和水,足量的氯化钙能将也呈碱性的碳酸钠完全反应,步骤③中观察到溶液为红色,说明溶液中含有氢氧化钠,因此确认第二种情况成立;
[总结提高]
倾倒液体药品时,为防止标签损坏,应注意标签向着手心,且药品取用完毕后应及时盖好瓶塞,防止试剂因接触空气而变质。

【题目】下列各图是进行氧气、二氧化碳的实验室制取和有关性质的实验装置。
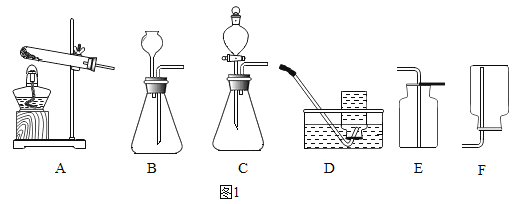
(1)图1某同学用A装置制氧气,写出该反应的化学方程式_______;若要制取一瓶二氧化碳,选用的装置为________。
(2)某化学兴趣小组的同学用图2所示的装置进行二氧化碳的性质实验(装置的气密性良好),先关闭止水夹,将足量的氢氧化钠滴入广口瓶中,充分反应后,再打开止水夹。
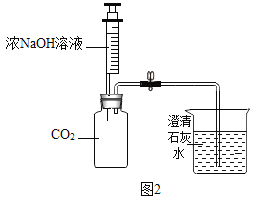
①广口瓶中观察到的现象__________。
②实验结束后,兴趣小组的同学提出新问题,广口瓶内液体的溶质可能是什么?
(猜想)
小亮:只有氢氧化钠;
小丽:氢氧化钠和氢氧化钙;
你的猜想:_______。
(探究与验证)
根据反应原理,该兴趣小组的甲、乙两位同学分别设计下列方案,对小组的猜想进行验证。实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容。
实验操作 | 现象 | 结论 | |
甲 | 取少量广口瓶内液体,滴加几滴酚酞试液 | 溶液变红 | 小丽的猜想成立 |
乙 | 取少量广口瓶内液体,滴加_______(写一种盐溶液) | 产生白色沉淀 | 你的猜想成立 |
(反思与评价)
同学们认真研究实验流程,讨论后一致认为乙同学的方案合理。你认为甲同学设计的方案不合理的理由是
_________。