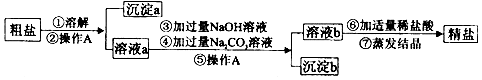
题目内容
10.在空格内填入可除去括号中杂质的试剂或操作的序号:①铁粉、②稀盐酸、③灼热的氧化铜、④在空气中加热、⑤点燃
(1)CO2(CO)③; (2)NaCl(Na2CO3)②;
(3)FeSO4(CuSO4)①; (4)CuO(Cu)④.
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:(1)CO能与灼热的氧化铜反应生成铜和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则.
(2)要除去NaCl中的Na2CO3,实质就是除去碳酸根离子,可利用碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,然后蒸发即可,能除去杂质且没有引入新的杂质,符合除杂原则.
(3)要除去FeSO4溶液中的CuSO4,实质就是除去铜离子,可利用CuSO4溶液与铁粉反应生成硫酸亚铁溶液和铜,然后过滤即可,能除去杂质且没有引入新的杂质,符合除杂原则.
(4)Cu在空气中加热生成氧化铜,能除去杂质且没有引入新的杂质,符合除杂原则.
故答案为:(1)③;(2)②;(3)①;(4)④.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

练习册系列答案
相关题目
1.除去下列物质中的杂质,所用试剂和方法不正确的是( )
| 选项 | 物质 | 杂质 | 除杂质所用试剂和方法 |
| A | MnO2 | KCl | 足量水、过滤 |
| B | NaOH溶液 | Na2CO3 | 适量Ca(OH)2溶液,过滤 |
| C | KNO3溶液 | K2SO4 | 适量BaCl2溶液,过滤 |
| D | Cu | Fe | 足量稀盐酸、过滤 |
| A. | A | B. | B | C. | C | D. | D |
18.某电镀厂排出的酸性污水中,含有有毒的Cu2+,欲除去Cu2+,并降低其酸性,加入适量下列物质不能达到目的是( )
| A. | 烧碱 | B. | 生石灰 | C. | 氯化铁 | D. | 铁粉 |
15.下列实验操作能达到测量要求的是( )
| A. | 温度计上显示的室温读数为122.18℃ | |
| B. | 用pH试纸测得溶液pH为6.2 | |
| C. | 用100ml筒量取7.00ml稀硫酸 | |
| D. | 用托盘天平称量5.2g氢氧化钠 |
2.中和反应在生活生产中有广泛的应用.下列做法利用中和反应原理的是( )
| A. | 用盐酸除去铁锈 | B. | 用氨水(NH3•H2O)处理工厂的硫酸 | ||
| C. | 用碳酸钙作补钙剂 | D. | 用含氧化镁的药物治疗胃酸过多 |
19.甲、乙两种物质的溶解度曲线如图所示.下列说法中正确的是( )
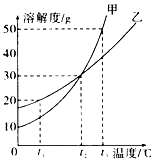

| A. | t3℃时,要使质量相同的甲、乙两种物质全部溶解,至少需要的水的质量乙大于甲 | |
| B. | t1℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液 | |
| C. | t2℃时,甲、乙饱和溶液的溶质质量分数都为30% | |
| D. | t2℃时,甲、乙的饱和溶液分别降温至t1℃,降温后甲溶液饱和而乙溶液不饱和 |
20.下列有关合金的说法错误的是( )
| A. | 铝合金是一种化合物 | B. | 生铁是一种铁的合金 | ||
| C. | 黄铜的硬度比纯铜的硬度大 | D. | 焊锡的熔点比锡的熔点低 |