题目内容
1.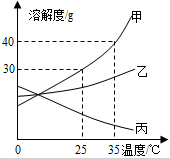 甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:(1)若甲固体中含有少量乙,则提纯甲的方法是降温结晶(填“蒸发器皿”或“降温结晶”);
(2)将25℃时乙的饱和溶液升温到35℃,则其溶液的溶质质量分数不变(填“变大”、“变小”或“不变”);
(3)25℃时,将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,得到溶液的质量为65g.
分析 根据题目信息和溶解度曲线可知:甲、乙两种固体物质的溶解度,都是随温度升高而增大,而丙的溶解度随温度的升高而减少;若甲固体中含有少量乙,则提纯甲的方法是降温结晶,因为甲的溶解度受温度的影响变化比乙大;将25℃时乙的饱和溶液升温到35℃,则其溶液的溶质质量分数不变,因为乙的溶解度随温度升高而增大,升温后乙有饱和变为不饱和;25℃时,甲的溶解度是30g,因此将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,得到溶液的质量=15g+50g=65g.
解答 解:(1)若甲固体中含有少量乙,则提纯甲的方法是降温结晶,因为甲的溶解度受温度的影响变化比乙大;故答案为:降温结晶;
(2)将25℃时乙的饱和溶液升温到35℃,则其溶液的溶质质量分数不变,因为乙的溶解度随温度升高而增大,升温后乙有饱和变为不饱和;故答案为:不变;
(3)25℃时,甲的溶解度是30g,因此将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,得到溶液的质量=15g+50g=65g;故答案为:65;
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液的计算,有关的计算要准确,本考点主要出现在选择题和填空题中.

练习册系列答案
相关题目
15.在AlCl3溶液中逐滴加入NaOH溶液至过量,发生如下反应:3NaOH+AlCl3═Al(OH)3↓+3NaCl,Al(OH)3+NaOH═NaAlO2+2H2O,下列图象正确的是( )
| A. |  | B. |  | C. |  | D. |  |
6. 在杠杆的两端挂着质量和体积都相同的铁球和铝球,这时杠杆平衡,将两球分别浸泡在质量相同、溶质质量分数也相同的稀硫酸中(如图所示)直至两个烧杯中均没有气泡产生为止,两球的外形变化不大且无孔洞出现,下列推测中不正确的是:(金属球上附着的液体忽略不计,下同)( )
在杠杆的两端挂着质量和体积都相同的铁球和铝球,这时杠杆平衡,将两球分别浸泡在质量相同、溶质质量分数也相同的稀硫酸中(如图所示)直至两个烧杯中均没有气泡产生为止,两球的外形变化不大且无孔洞出现,下列推测中不正确的是:(金属球上附着的液体忽略不计,下同)( )
 在杠杆的两端挂着质量和体积都相同的铁球和铝球,这时杠杆平衡,将两球分别浸泡在质量相同、溶质质量分数也相同的稀硫酸中(如图所示)直至两个烧杯中均没有气泡产生为止,两球的外形变化不大且无孔洞出现,下列推测中不正确的是:(金属球上附着的液体忽略不计,下同)( )
在杠杆的两端挂着质量和体积都相同的铁球和铝球,这时杠杆平衡,将两球分别浸泡在质量相同、溶质质量分数也相同的稀硫酸中(如图所示)直至两个烧杯中均没有气泡产生为止,两球的外形变化不大且无孔洞出现,下列推测中不正确的是:(金属球上附着的液体忽略不计,下同)( )| A. | 若铝球是空心的,则铁球一定也是空心的 | |
| B. | 拿掉烧杯后,杠杆仍然平衡 | |
| C. | 拿掉烧杯后,要想使杠杆平衡,支点应向N端移动 | |
| D. | 拿掉烧杯后,放铁球的那个烧杯中溶液质量大 |
13.“金银铜铁锡”俗称五金,是被广泛使用的金属材料.在这五种金属中,活动性最弱的是( )
| A. | 金 | B. | 银 | C. | 铁 | D. | 锡 |
11.某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图1所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
老师提示:I.电解饱和食盐水的化学方程式:
2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑

Ⅱ.忽略其他可能发生的反应对以下实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
探究活动二:测定待测液中氢氧化钠的质量分数
【实验1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加
入一定溶质质量分数的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据
如下:
(2)写出氢氧化钠与稀盐酸反应的化学方程式:NaOH+HCl═NaCl+H2O.
(3)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据,计算所称取待测液中氢氧化钠的质量,应从选用稀盐酸的体积为9.8mL.
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液中发生反应:2NaOH+MgCl2=Mg(OH)2↓+2NaCl
乙组同学按图2所示的实验步骤进行实验:
(4)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加氢氧化钠溶液,产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论).
(5)步骤③过滤出的沉淀物是氢氧化镁.
(6)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
老师提示:I.电解饱和食盐水的化学方程式:
2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑

Ⅱ.忽略其他可能发生的反应对以下实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
| 实验步骤 | 实验现象 | 实验结论 |
向待测液中滴加几滴酚酞试液 | 酚酞试液变红色 | 待测液呈碱性,表明含有氢氧化钠 |
【实验1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加
入一定溶质质量分数的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据
如下:
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 |
(3)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据,计算所称取待测液中氢氧化钠的质量,应从选用稀盐酸的体积为9.8mL.
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液中发生反应:2NaOH+MgCl2=Mg(OH)2↓+2NaCl
乙组同学按图2所示的实验步骤进行实验:
(4)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加氢氧化钠溶液,产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论).
(5)步骤③过滤出的沉淀物是氢氧化镁.
(6)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
 据报道:一颗陨石在俄罗斯中部乌拉尔山区坠落,陨石进入大气层时,速度达到了音速的40倍,而落地前的速度减小到了30千米/时,由此引发的“陨石雨”导致1200多名当地居民受伤.
据报道:一颗陨石在俄罗斯中部乌拉尔山区坠落,陨石进入大气层时,速度达到了音速的40倍,而落地前的速度减小到了30千米/时,由此引发的“陨石雨”导致1200多名当地居民受伤.