题目内容
15.在AlCl3溶液中逐滴加入NaOH溶液至过量,发生如下反应:3NaOH+AlCl3═Al(OH)3↓+3NaCl,Al(OH)3+NaOH═NaAlO2+2H2O,下列图象正确的是( )| A. |  | B. |  | C. |  | D. |  |
分析 A、随着加入氢氧化钠溶液至过量,溶液中水的质量会持续不断增加;
B、滴入的氢氧化钠被氯化铝反应掉不断生成氢氧化铝沉淀,直至溶液中的氯化铝全部反应;随后,滴入的氢氧化钠与生成的氢氧化铝沉淀发生反应,生成易溶于水的NaAlO2,而使沉淀逐渐消失;
C、开始加入氢氧化钠时,先发生反应:3NaOH+AlCl3═Al(OH)3↓+3NaCl,不会生成NaAlO2;
D、滴入的氢氧化钠逐渐把氯化铝变成氢氧化铝沉淀而使溶液中铝元素的质量不断减小,直至全部沉淀而使溶液中铝元素质量变为零;随后滴入的氢氧化钠把沉淀氢氧化铝变成易溶于水的NaAlO2,而使溶液中铝元素质量逐渐增加,至沉淀全部溶解.
解答 解:A、图中所示,随氢氧化钠溶液的滴加,溶液中水的质量逐渐增大,当加入一定量时会出现滴加氢氧化钠溶液而水的质量不增加的阶段而后继续增加;而反应的事实却是溶液中水会随氢氧化钠溶液的滴加而不断增加;故A不正确;
B、图中所示,随着氢氧化钠的滴加,溶液中的氯化铝不断形成氢氧化铝沉淀,沉淀质量逐渐增加;至完全反应后,随氢氧化钠的滴加沉淀逐渐减少;符合氯化铝先与氢氧化钠生成氢氧化铝沉淀然后沉淀氢氧化铝又与所滴加的氢氧化钠生成可溶的NaAlO2的反应事实;故B正确;
C、开始加入氢氧化钠时,先发生反应:3NaOH+AlCl3═Al(OH)3↓+3NaCl,不会生成NaAlO2;故C不正确;
D、图中所示,随着氢氧化钠溶液的滴加,溶液中铝元素质量减少至完全消失;之后,随氢氧化钠溶液滴加溶液中铝元素质量又逐渐增加;符合氯化铝先与氢氧化钠生成氢氧化铝沉淀然后沉淀氢氧化铝又与所滴加的氢氧化钠生成可溶的NaAlO2的反应事实,根据化学反应中元素质量守恒,到最后铝元素的质量会于开始时铝元素质量相等;故D不正确.
故选B.
点评 根据反应进程,分析反应对溶液其它因素的影响,结合表示该因素变化的曲线,判断曲线与反应事实是否相符.

| A. |  检验CO2是否集满 | B. |  取用液体 | ||
| C. |  铁丝在氧气中燃烧 | D. |  加热液体 |
| A. | 误服碳酸钡后用硫酸镁解毒:BaCl2+MgSO4═MgCl2+BaSO4↓ 复分解反应 | |
| B. | 石灰水刷墙,墙壁变白变硬:Ca(OH)2+CO2═CaCO3↓+H2O 非基本反应类型 | |
| C. | 向生石灰中加入石蕊溶液石灰水变蓝:CaO+H2O═Ca(OH)2 化合反应 | |
| D. | 在高炉中用赤铁矿炼铁:3CO+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 置换反应 |
 “登高取物”游戏规则:梯子上下相邻的物质之间能发生反应的,游戏者可以上升一格,最终登顶者可以获得“足球”奖励(如图).乙同学根据规则能顺利从BaCI2、CaCO3、KNO3、NaCI中选择合适物质填入②处,也顺利获奖.正确的选项为( )
“登高取物”游戏规则:梯子上下相邻的物质之间能发生反应的,游戏者可以上升一格,最终登顶者可以获得“足球”奖励(如图).乙同学根据规则能顺利从BaCI2、CaCO3、KNO3、NaCI中选择合适物质填入②处,也顺利获奖.正确的选项为( )| A. | BaCI2 | B. | CaCO3 | C. | KNO3 | D. | NaCI |
查阅资料:铜属于重金属,钠不是重金属.
设计实验:取试管4支,编号,按表分别加入试剂,摇匀,迅速置于37℃的水浴中,10分钟后取出,冷却后分别加入3滴碘液,观察其颜色变化.
| 编号 | 0.25%淀粉 溶液(ml) | 蒸馏水(ml) | 0.9%NaCl 溶液(ml) | 0.9%CuSO4溶液(ml) | 唾液溶液(ml) | 加入3滴 碘液后现象 |
| 1 | 3 | 2 | - | - | - | 变蓝色 |
| 2 | 3 | 1 | - | - | 1 | 不变蓝 |
| 3 | 3 | - | 1 | - | 1 | 不变蓝 |
| 4 | 3 | - | - | 1 | 1 | 变蓝色 |
(2)将三支试管分别放入37℃的水浴中的原因是37℃时酶的活性最强.
(3)在看了小科的设计及实验后,同桌的小雪认0为凭上述实验还不足以证明小科的猜想.你认为应该如何对原实验进行改进?0.9%的CuSO4溶液改为0.9%的CuCl2溶液.
| A. | 浓硫酸可以干燥氨气 | |
| B. | 不能直接品尝实验室药品的味道 | |
| C. | 误食重金属盐,可服牛奶或鸡蛋清解毒 | |
| D. | 液化气起火,迅速关闭阀门,以断绝可燃物的来源 |

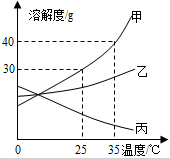 甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答: